L'innovation expérimentale
Ce développement de solutions thérapeutiques, avec un nouveau paradigme, est déjà présent dans le champ de l'immunothérapie et de certaines maladies rares
Dans ce cadre, la coordination de ces acteurs en "écosystème" est indispensable, mais elle n'est plus suffisante. Une profonde évolution des processus de qualification des essais cliniques, des dispositifs d'évaluation et de la mise sur le marché des traitements et de leurs modalités d'accès apparaît nécessaire.
De la recherche fondamentale aux stratégies thérapeutiques : les enjeux
De plus en plus de médicaments ou solutions thérapeutiques permettant de soigner la maladie s'adresseront à une cible réduite ou très réduite de patients (médicaments orphelins, médecine de précision...).
Ces médicaments, qui bouleversent la prise en charge et la vie des patients, impactent aussi notre système de santé.
En effet, bien souvent, ils ne s'intègrent plus au schéma classique de la chaîne de valeur des produits de santé : les essais cliniques sont réalisés sur un très petit nombre de patients, les autorisations de mise sur le marché sur la base d'essais cliniques plus courts, les prix et les remboursements sont plus complexes du fait du très petit nombre de patients et de coûts de R&D très conséquents, etc.
Ces solutions thérapeutiques nécessitent donc, pour leur pleine diffusion, une profonde transformation de notre écosystème de santé.
L'émergence d'innovations allant au-delà des médicaments nécessite elle aussi une adaptation de notre écosystème.
En effet, les solutions multi-technologiques de santé ou l'algorithmie, par exemple, s'accompagnent de défis immenses sur toute la chaîne de valeur du progrès thérapeutique.
Il n'existe pas de cadre propice à leur développement et à leur diffusion : l'enjeu est donc bel et bien de prendre en considération les spécificités de ces nouvelles familles d'innovation, d'en anticiper l'impact sur nos modèles existants (R&D, production, accès au marché, commercialisation...), et de transformer notre écosystème pour favoriser leur développement.
Question clé 1 : comment assurer la continuité entre les différentes structures de la recherche et de l'innovation ?
D'ici à 2030, un nouveau modèle d'innovation pour les traitements aura émergé dans un schéma d'apprentissage associant la recherche fondamentale, la recherche translationnelle ou expérimentale, la recherche clinique et la recherche épidémiologique.
Il partira d'un modèle conceptuel, nourri par des bases de données partagées et par l'identification des cibles, pour revenir au patient puis au modèle conceptuel.
Le modèle humain prendra de plus en plus d'importance, à côté du modèle numérique, dans tous les domaines de la recherche fondamentale en sciences de la vie.
Question clé 2 : quelle place pour l'épidémiologie dans le processus d'innovation ?
Pendant longtemps, la place de l'épidémiologie a peu progressé dans le cercle des innovations, laissant la prééminence à la compréhension des mécanismes cellulaires et moléculaires in vitro.
La transformation des pathologies et de leur origine (zoonoses et maladies "de civilisation") d'une part, les technologies de mesure et de traitement disponibles aujourd'hui, d'autre part, ainsi que la sensibilité du public changent la donne.
L'étude de la répartition et des déterminants des événements de santé sert de plus en plus de fondement à la logique des interventions faites dans l'intérêt de la santé publique et de la prévention et à la compréhension des origines des pathologies.
La fréquence des alertes récentes liées à la suspicion des effets de certains polluants sur le développement des embryons, causes de malformations majeures, les risques de nouvelles pathologies liées à la prolifération d'espèces animales (cas du moustique-tigre Aedes albopictus porteur des arbovirus du chikungunya, de la dengue et du virus Zika) sont des sujets de grandes préoccupations de santé publique et d'attente citoyenne qui nécessitent le renforcement et l'approfondissement des travaux et interventions épidémiologiques.
Les liens entre état de santé et environnement devront conduire à un fort développement de l'écologie environnementale en relation avec les spécialistes concernés des milieux et des polluants, de l'éco-épidémiologie (notamment des zoonoses en relation avec le monde vétérinaire mais aussi avec le bioterrorisme).
Question clé 3 : comment détecter et anticiper les innovations pour adapter les processus ?
Dans tous les cas de figure, l'anticipation des innovations pour l'ensemble des parties prenantes du système de santé (régulateurs, organismes de financement, monde médical) devient indispensable.
Les systèmes de détection précoce s'appuient notamment sur les bases d'essais cliniques existantes pour initier la collecte d'information, principalement sur les essais de phases II et III. Cela suffira-t-il pour certaines thérapies (on pense notamment à l'immunothérapie) ?
Avec une analyse anticipée de deux à trois ans avant l'arrivée sur le marché des médicaments, ces outils permettront au public de mesurer la portée des innovations à attendre - les modèles les plus aboutis partageant les résultats publiquement - ; de préparer les nouvelles logiques d'évaluation des médicaments ; d'anticiper l'impact organisationnel, voire budgétaire, sur les systèmes de santé en place.
La question est de savoir à qui reviendra la coordination de ces systèmes de détection précoce de l'innovation.
Au système public ? Aux acteurs industriels ? Au tiers indépendant des autorités et des industriels ?
Question clé 4 : quelle coopération entre acteurs ?
Face aux grands défis médicaux (de la connaissance aux traitements) qui résistent (maladie d'Alzheimer...) ou qui se développent (antibiorésistance.), les acteurs de la recherche et de l'industrie et les pouvoirs publics ont pris conscience qu'aucun d'eux ne pourrait apporter seul une solution à ces sujets très complexes, risqués et nécessitant le temps long.
Les consortiums (publics-privés ou privés-privés) se développent au sein d'une approche plus ouverte de l'innovation, dans les phases dites précompétitives.
Question clé 5 : comment assurer la continuité de portage et d'appui aux porteurs de projets ?
Recherche, innovation et transfert technologique ont permis de faire émerger un écosystème dynamique de start-up en France.
Aujourd'hui, l'innovation en santé est très souvent initiée par de jeunes pousses depuis les phases amont jusqu'aux premiers stades des essais cliniques, aussi bien pour les médicaments que pour les dispositifs médicaux, le diagnostic et maintenant les solutions numériques de santé.
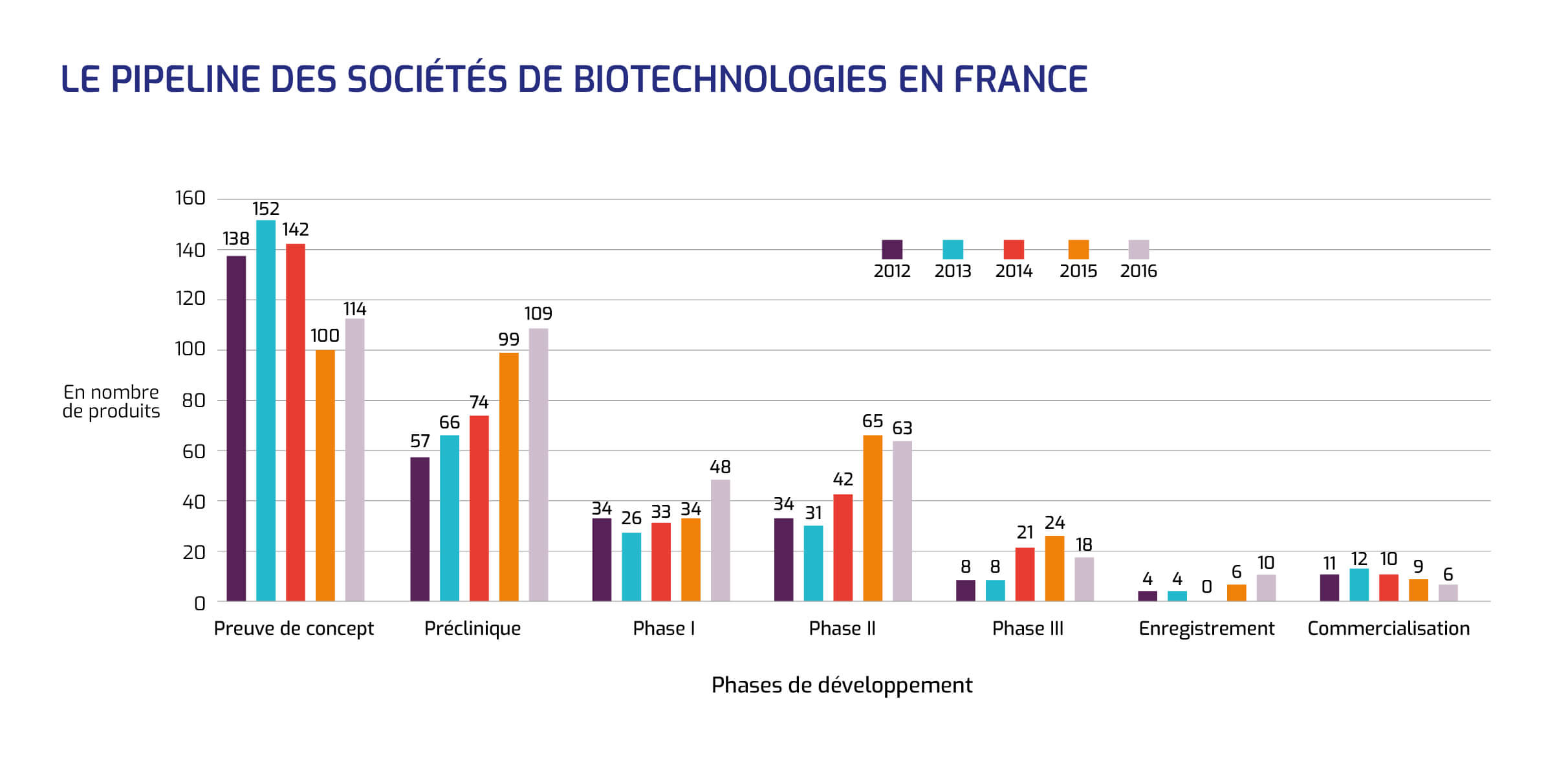
Le pipeline des sociétés françaises de biotechnologies totalise 368 produits allant de la preuve de concept jusqu'à la commercialisation.
Les deux tiers des programmes de développement sont en phase précoce : recherche de la preuve de concept et phase préclinique, tandis que près d'un quart sont situés en phases plus avancées (phase II et phase III). Dix produits sont actuellement en cours d'enregistrement et 6 sont commercialisés.
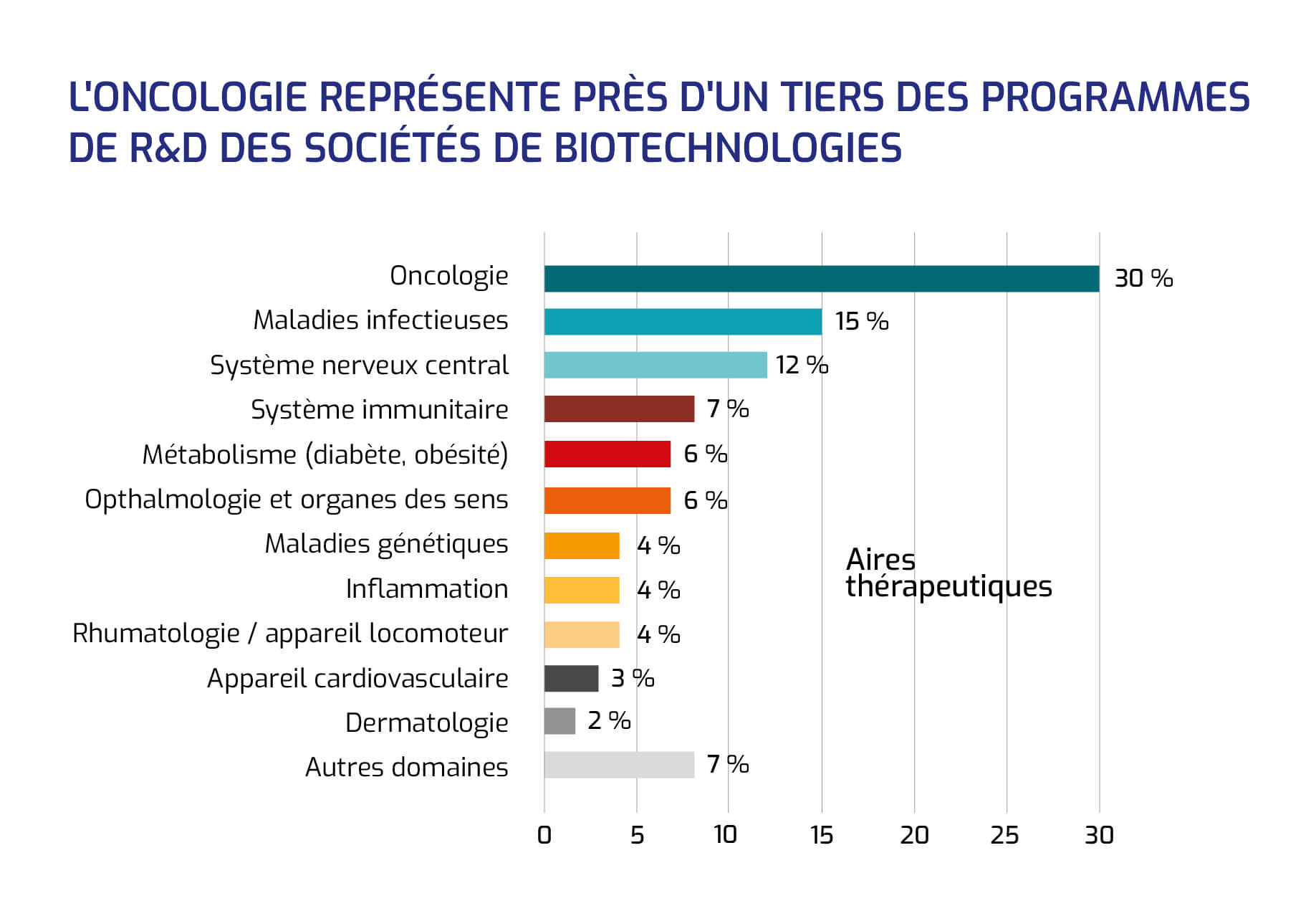
L'oncologie représente près d'un tiers des programmes de R&D des sociétés de biotechnologies
Les trois aires thérapeutiques les plus investiguées pas les sociétés de biotechnologies françaises sont l'oncologie (1/3 des programmes, soit 110 produits) les maladies infectieuses (15 %, avec 59 produits en développement) et le système nerveux central (12 %, avec 44 produits).
(Dynamique 1 : "L'innovation expérimentale")
Extrait de Santé 2030 - Partie 1 : les dynamiques à l'oeuvre. Retrouvez l'intégralité de l'étude sur le site.

