L'épigénétique
De quoi parle-t-on ?
Définition
Le génotype représente l'ensemble de la composition génétique d'un individu.
Le génotypage est donc la discipline qui vise à déterminer la nature d'une variation génétique à une position spécifique dans le génome, pour un individu donné.
On estime que les différences entre deux êtres humains sont d'environ 3 millions de nucléotides sur les 3 milliards constituant leur génome. Le phénotype est l'ensemble des caractéristiques observables d'un organisme (anatomiques, morphologiques, moléculaires ou physiologiques). Il est déterminé à la fois par les gènes et par l'environnement.
Le terme épigénétique a été proposé pour la première fois par Conrad Hal Waddington dans les années 1940 comme "la branche de la biologie qui étudie les relations de cause à effet entre les gènes et leurs produits, lesquelles donnent naissance au phénotype".
Aujourd'hui, la définition la plus courante de l'épigénétique est "l'étude des changements héréditaires dans la fonction des gènes, ayant lieu sans altération de la séquence de l'ADN".
Pour prendre une métaphore, la génétique renvoie à l'écriture des gènes, l'épigénétique à leur lecture. L'accessibilité d'un gène dans le noyau d'une cellule, et donc sa capacité à être transcrit puis traduit en une protéine, va dépendre de modifications chimiques de l'ADN (par exemple, la méthylation) et de protéines qui entourent l'ADN.
L'épigénome est l'ensemble des modifications épigénétiques d'une cellule.
L'hérédité épigénétique est fondamentale au niveau cellulaire, car elle contribue dans l'organisme à la mémoire de l'identité des cellules.
Les modifications épigénétiques sont influencées par l'environnement intrinsèque ou extrinsèque. Notre mode de vie pourrait ainsi laisser dans nos cellules une "trace épigénétique" éventuellement transmissible d'une génération à l'autre.
La découverte de la structure en double hélice de l'ADN en 1953 par James Watson et Francis Crick a amené l'ADN au premier plan et tous les regards (et les recherches) se sont tournés vers la génétique, menant au développement de technologies de séquençage de l'ADN dans les années 1980.
Le XXIe siècle a commencé avec la publication de la séquence de l'ensemble du génome humain. Mais, contrairement à ce qui était attendu, décoder le génome n'a pas permis de répondre à toutes les questions que les chercheurs se posaient, notamment en matière de traitement de nombreuses maladies génétiques.
Les mécanismes épigénétiques
Pour chaque être vivant, l'information génétique est portée par l'ADN, dont la séquence est identique dans toutes les cellules d'un même organisme. Elle est codée par l'enchaînement spécifique des quatre bases nucléiques : adénine, thymine, cytosine et guanine A-T-C-G.
Le décryptage de ce code à quatre lettres ne permet pas d'expliquer comment une même succession peut donner autant de combinaisons.
Un des exemples les plus parlants est qu'à partir d'une cellule souche unique naît un organisme entier composé de cellules différentes, tant au niveau de leur structure que de leur fonction. Ces cellules ayant toutes la même origine possèdent exactement le même code génétique, qui est interprété différemment grâce à une batterie de mécanismes épigénétiques.
Chaque cellule exploite plusieurs types de mécanismes épigénétiques indépendants, dont le mode d'action fait intervenir l'ADN et des protéines.
En effet, pour que le noyau d'une cellule de 5 à 6 micromètres de diamètre puisse contenir deux mètres d'ADN, plusieurs niveaux de compaction sont nécessaires.
Certains mécanismes épigénétiques agissent sur la structure de la chromatine, en la faisant passer d'un état condensé à un état décondensé, ou inversement, selon qu'un gène a besoin d'être exprimé ou réprimé. D'autres interviennent directement au niveau de séquences régulatrices de l'ADN au voisinage des gènes.
Ces séquences particulières ne codent pour aucune protéine, mais contrôlent où et quand les gènes sont exprimés.
La double hélice d'ADN s'enroule autour d'octamères de protéines, appelées histones, pour former des nucléosomes.
Puis, ces structures sont organisées dans l'espace pour former des fibres de chromatine plus ou moins denses.
L'état très compact est appelé hétérochromatine et empêche la transcription des gènes. L'état le moins condensé, l'euchromatine, contient la portion active du génome.
Ces altérations permettent de réguler l'expression des gènes sans changer la séquence de l'ADN.
Pour donner une image métaphorique, si le génome est comparé aux phrases d'un livre, l'épigénome correspond à ses accents : un même texte peut alors être interprété différemment selon que certains mots ont des accents graves, aigus ou circonflexes.
L'état d'activation de nos gènes est donc soumis à de nombreux outils disponibles dans le noyau de chaque cellule.
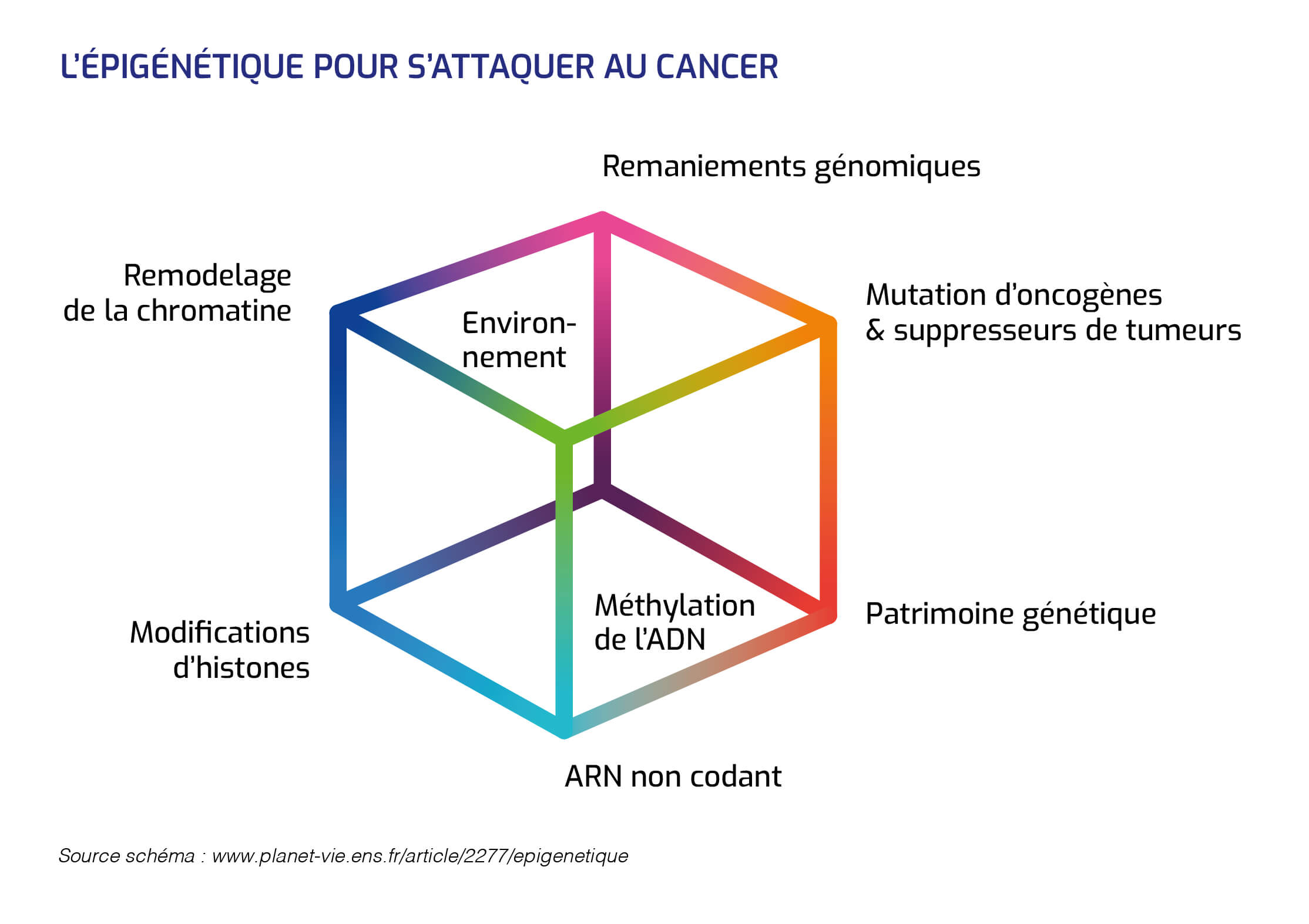
Deux mécanismes de modulation de l'activité des gènes
L'épigénétique désigne des processus qui gouvernent l'activité des gènes sans affecter la séquence de l'ADN.
Ils font appel à deux mécanismes de modifications des états de la chromatine : l'enroulement de la molécule d'ADN autour de protéines, les histones, qui constituent les chromosomes.
Ces états chromatiniens sont très sensibles aux facteurs de l'environnement. Leurs modifications pourraient être en cause dans le vieillissement et dans certaines maladies.
1. Méthylation de l'ADN
C'est l'un des principaux mécanismes épigénétiques : il passe par l'addition de "groupes méthyles" sur des nucléotides (les "lettres" A, T, G et C qui forment la séquence de l'ADN). Une faible méthylation favorise l'activité des gènes, mais une forte méthylation l'inhibe.
2. Modification des histones
L'ADN est enroulé autour de protéines, les histones, pour former de petites billes. L'ajout de groupes chimiques sur ces histones conditionne la compacité de ces enroulements et peut modifier l'accessibilité de certains gênes, qui sont alors ou non traduits en protéines.
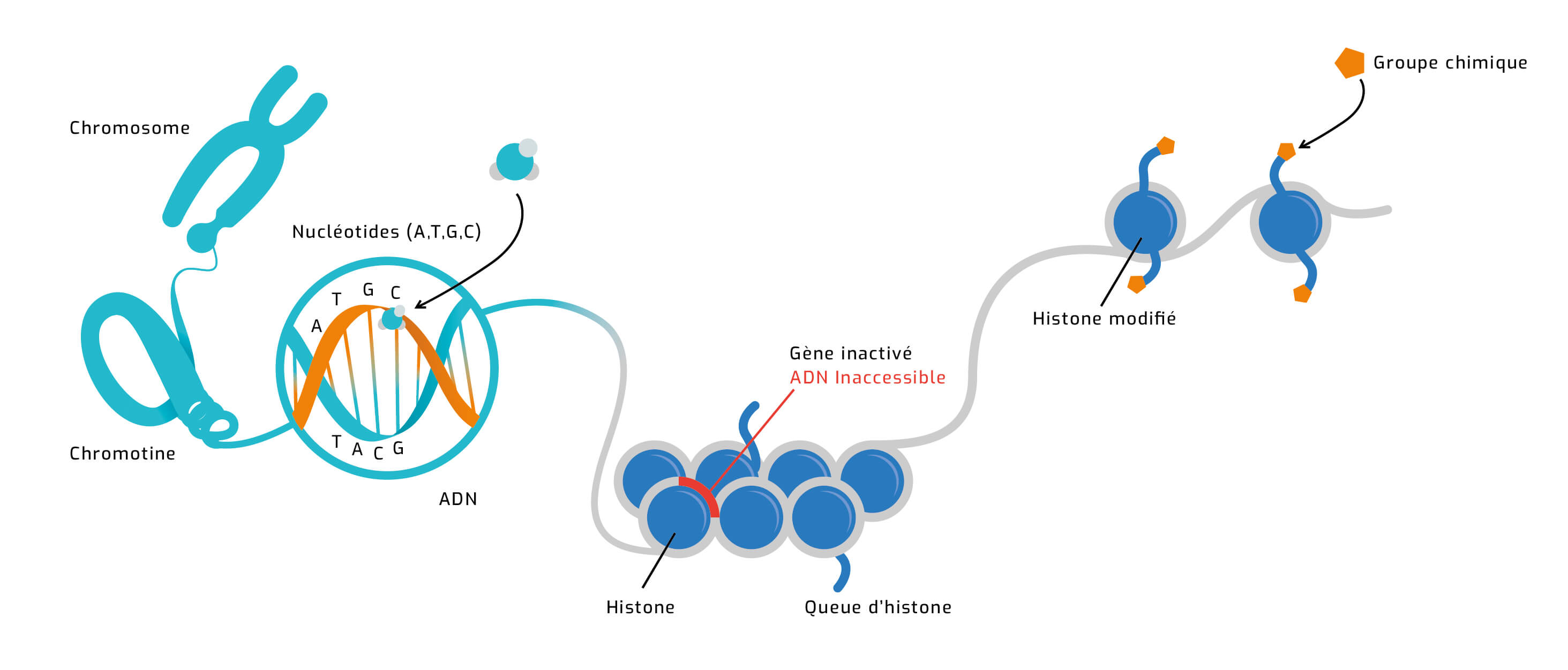
L'épigénétique intervient à trois niveaux
1. A l'échelle de l'individu : lors du développement, elle joue un rôle important dans la différenciation des cellules et le maintien de leur identité pendant toute la vie.
2. A l'échelle des générations : certains états chromatiniens peuvent être transmis à la descendance sur plusieurs générations.
3. A l'échelle des temps évolutifs : les experts s'interrogent sur son rôle dans l'évolution des espèces.
Les mécanismes épigénétiques sont responsables de l'identité de nos cellules, mais ils peuvent aussi contribuer à déterminer qui nous sommes.
Par exemple, des jumeaux homozygotes, qui partagent exactement la même séquence génomique, sont néanmoins différents, en raison, notamment, d'un épigénome propre à chacun.
Mais si les phénomènes épigénétiques font partie de notre vie quotidienne et garantissent notre bonne santé, leur dérèglement peut provoquer certaines maladies comme des cancers, la maladie d'Alzheimer, la dépression ou l'asthme.
Cependant, à la différence du code génétique, dont les mutations sont irréversibles, les modifications résultant de phénomènes épigénétiques sont potentiellement réversibles et varient en fonction de l'environnement de la cellule. Elles offrent donc un futur prometteur au développement de médicaments dans le traitement des pathologies évoquées.
"Les variations épigénétiques sont assez plastiques. Elles peuvent être effacées par des traitements chimiques, ce qui ouvre d'immenses perspectives thérapeutiques. Cet espoir s'est déjà concrétisé par le développement de premières ‘épidrogues'pour traiter certains cancers." (Edith Heard, professeure au Collège de France, titulaire de la chaire Epigénétique et Mémoire cellulaire).
Ce qui se profile d'ici 2030
Comprendre la complexité de la relation entre génotype et phénotype et explorer les liens entre les variations génétiques individuelles, l'environnement et les maladies humaines.
- L'identification de nombreuses maladies dues à des mutations ou à des altérations épigénétiques dans des gènes spécifiques permettra un diagnostic moléculaire approfondi (pré et post-natal).
- L'épigénétique sera mieux prise en compte dans l'apparition de maladies. La connaissance des mécanismes de la maladie permettra le développement de traitements ciblés et performants, adaptés à des altérations spécifiques, diminuant ainsi les effets secondaires délétères.
- La compréhension du lien entre le génotype et le phénotype marquera le début d'une ère de la médecine personnalisée et d'une meilleure appréciation des risques de maladie et des susceptibilités : parallèlement au développement de la pharmacogénétique, on assistera à celui de la pharmaco-épigénétique.
- Ces avancées dans le domaine de la génétique/épigénétique seront accompagnées d'améliorations dans la conception de médicaments, dans les approches de thérapie génique, de chirurgie du gène et dans les thérapies à base de cellules souches.
- Nous allons continuer à apprendre comment notre environnement, notre alimentation et notre mode de vie interagissent avec notre patrimoine génétique, et comment ils impactent l'état de notre épigénome pour déterminer notre santé et notre susceptibilité aux maladies.
Ce qui est en cours
L'avènement de l'épigénétique a modifié la manière de penser les pathologies héritables en y incluant la dimension environnementale, d'où la multiplication des travaux sur l'importance de l'altération de l'empreinte épigénétique dans le développement de nombreuses maladies.
Quand la thérapie génique consiste à changer les gènes, la "thérapie épigénétique" pourrait agir sur l'expression des gènes. Elle peut consister également à agir directement sur la nature des constituants de l'ADN.
C'est le cas des thérapies visant à réactiver un gène silencieux, permettant d'empêcher la méthylation de l'ADN (qui conditionne notamment l'expression des gènes dans chaque cellule).
Ces solutions peuvent se montrer efficaces dans le traitement du cancer du poumon et certaines leucémies lorsqu'elles sont liées à une hyperméthylation de l'ADN.
En 2016, le marché des épidrogues anti-cancéreuses est extrêmement dynamique et porteur.
Il représente 2,7 milliards de dollars et augmente de 25 % par an.
Les acteurs sont majoritairement américains. On y recense notamment des entreprises du médicament, des entreprises de taille intermédiaire (ETI) et quelques start-up, dont EpiReMed (issue de l'unité de pharmacochimie de la régulation épigénétique du cancer du CNRS), Storm Therapeutics (GB), Cambridge Epigenetix (GB), Epizyme (Etats-Unis), Zenith Epigenetics (Canada).
Entre 2000 et 2016, l'épigénétique a engendré plus de 30 000 publications
Ce qu'il faut dépasser
Les prochaines décennies verront la naissance de progrès prometteurs dans la génétique, l'épigénétique et la génomique, ce qui ouvrira de nouvelles voies pour le diagnostic et le traitement des pathologies.
Les projets développés aujourd'hui concernent notamment le séquençage d'épigénomes ou la validation de cibles et le criblage d'inhibiteurs.
Citons notamment les cartographies de l'épigénome réalisées par le Roadmap Epigenomics Program, dirigé par le National Institutes of Health (NIH), et le projet Blueprint financé par l'Union européenne.
Le projet ENCODE (Encyclopedia of DNA Elements), mené par un consortium financé principalement par le National Human Genome Research Institute (NHGRI) américain, vise à identifier tous les éléments fonctionnels du génome et de l'épigénome humain.
Structurée en Europe et dans le monde autour de consortiums publics, la recherche en épigénétique doit inclure également des partenariats privés.
Le Structural Genomics Consortium (SGC), dont l'objectif est de produire en open data des structures tridimensionnelles de cibles épigénétiques pour développer de nouveaux inhibiteurs, regroupe de grands noms du secteur privé et public (AbbVie, Bayer, Janssen, Novartis, Pfizer, universités d'Oxford, de Toronto, l'Institut Karolinska...).
Les défis à relever
• Ces projets nécessiteront des investissements importants dans les nouvelles technologies, en particulier le séquençage à haut débit et la recherche sur les cellules souches.
• Ces technologies soulèvent de nouveaux défis, en rapport avec le stockage de données volumineuses et de matériel biologique sensible, et l'analyse des données et l'évaluation des risques. Il sera également important d'intégrer la compréhension des caractéristiques génétiques et épigénétiques dans des essais cliniques et des programmes de criblage des médicaments.
• Un autre défi sera de savoir comment développer des collaborations, d'une part entre chercheurs académiques et industriels, pour favoriser l'émergence de ces nouvelles thérapies, et d'autre part avec la communauté médicale, afin de transmettre cette information aux patients.
Les préalables pour relever ces défis
• La création de bases de données professionnelles, partagées et bien gérées, pour stocker des informations médicales et des données moléculaires, l'utilisation de l'intelligence artificielle et le développement d'algorithmes d'apprentissage en profondeur (deep learning) pour interpréter les résultats.
• Le développement de plateformes technologiques à haute performance, dotées des personnels assurant l'entretien, la gestion et l'analyse statistique de ces données.
• Le renforcement des interactions professionnelles entre la communauté scientifique et médicale et le grand public, ainsi que le perfectionnement des outils d'analyse.
• La mise en place de réseaux interdisciplinaires de collaborateurs, notamment de scientifiques et de philosophes, chargés d'étudier l'impact social des connaissances relatives à l'information génétique et épigénétique.
Fiche réalisée avec l'appui de Jonathan Weitzman, directeur du laboratoire Epigénétique et Destin cellulaire (UMR7216) et professeur à l'Université Paris Diderot.
Extrait de Santé 2030 - Partie 2 : les vecteurs d'innovation.
Retrouvez l'intégralité de l'étude sur le site.

