CRISPR-CAS9
De quoi parle-t-on ?
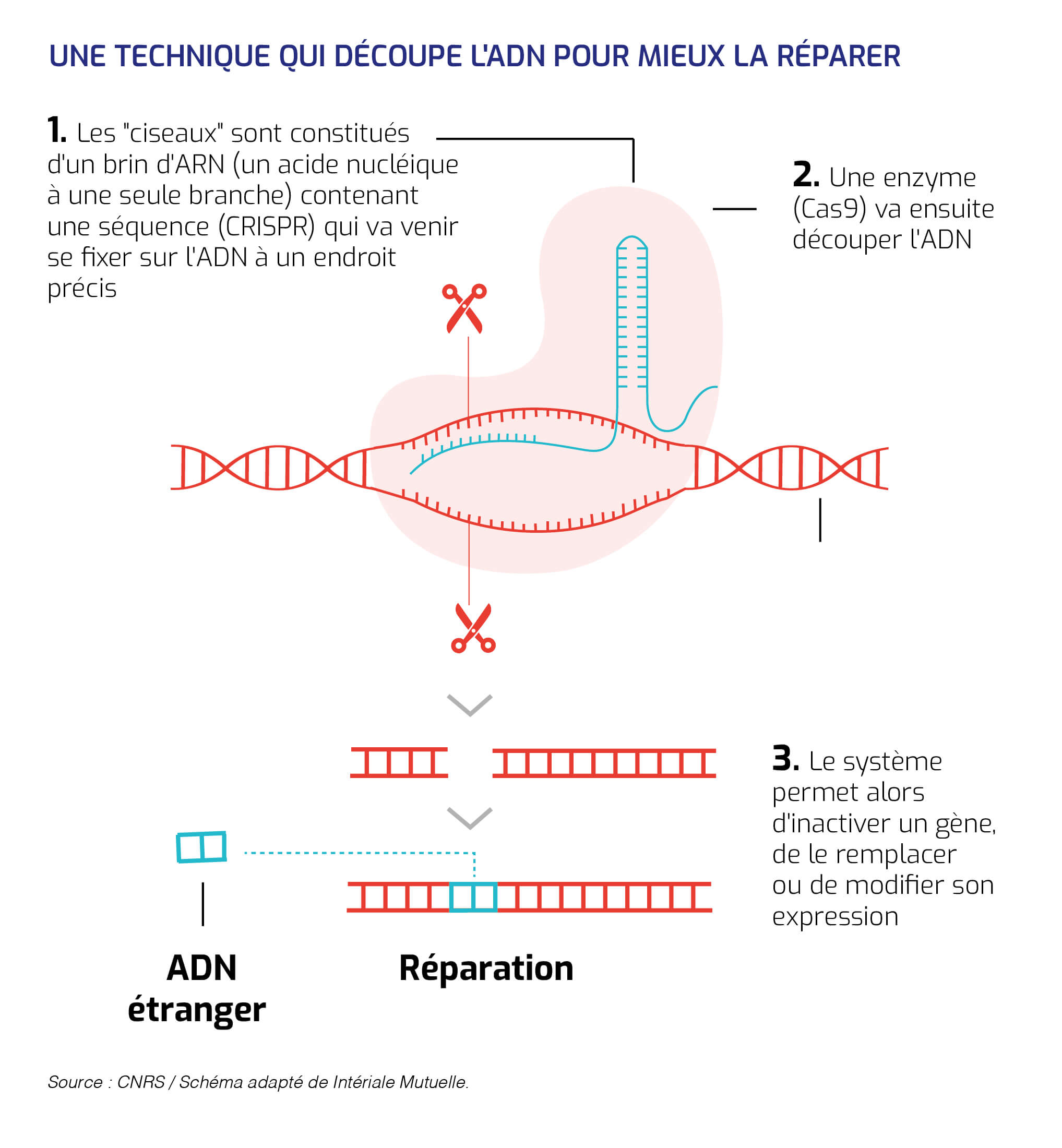
Après identification du gène à éliminer, ces "ciseaux moléculaires" peuvent le supprimer et le remplacer par un autre.
La technique CRISPR-Cas9 n 'est vieille que de 5 ans mais déjà, plus de 3 000 laboratoires de par le monde l'utilisent.
L'ADN, ou acide désoxyribonucléique, est un acide nucléique composé de désoxyribose, de phosphate, d'adénine (A), de cytosine (C), de guanine (G) et de thymine (T).
L'ADN contient les instructions génétiques utilisées dans le développement et le fonctionnement de tous les organismes vivants et de certains virus.
La fonction principale de la molécule d'ADN est le stockage à long terme de l'information pour construire d'autres composants des cellules, tels que des protéines et des molécules d'ARN.
Les segments d'ADN qui portent cette information génétique sont appelés gènes, mais les autres séquences d'ADN participent aussi à la régulation de l'utilisation de cette information génétique.
Ce qui se profile d'ici 2030
L'extension à l'infini des possibilités de la génétique
CRISPR-Cas9 étend les possibilités de la génétique à l'infini : supprimer un gène malade, le remplacer par une séquence saine ou encore étudier la fonction précise d'un gène...
Aucun secteur de la biologie n'y échappe, et de nouvelles applications sont publiées quotidiennement, d'autant plus que CRISPR-Cas9 est une technique exceptionnellement rapide.

Soigner les maladies génétiques
CRISPR-Cas9 a pour principale caractéristique de pouvoir reconnaître et couper une séquence d'ADN particulière.
Modifié par les chercheurs pour qu'il reconnaisse la séquence de leur choix, CRISPR-Cas9 peut ainsi potentiellement supprimer des mutations et devenir le pivot de thérapies géniques pour traiter de nombreuses maladies génétiques.
Comprendre le fonctionnement du cerveau
Les pistes de recherche foisonnent et avec elles de nombreux espoirs comme celui d'élucider le fonctionnement du cerveau.
L'utilisation de CRISPR démultiplie en effet les possibilités de recherche fondamentale en neurosciences : en coupant un gène précis sur un modèle animal, on peut déterminer plus précisément son rôle, dans le développement du cerveau par exemple.
De plus, elle ouvre la voie à de nombreuses applications thérapeutiques. Par exemple, si un gène est incriminé dans une maladie mentale, il devient envisageable, à terme, de l'éliminer, le corriger ou le remplacer avec ce bistouri génétique.
Dresser la carte génétique des maladies mentales
Il devient aussi possible d'établir le profil génétique d'un grand nombre de maladies mentales. D'autant plus qu'elles sont souvent multigéniques.
Pour l'autisme, par exemple, plus de 300 variations génétiques ont déjà été identifiées. Seulement, elles ne s'expriment pas toutes de la même façon au niveau des différents neurones.
Avec CRISPR-Cas9, il devient possible d'étudier ces variations génétiques.
D'ailleurs, les gènes codant pour une protéine ne sont pas les seules parties de l'ADN impliquées dans le développement de troubles.
Entre ces parties, il existe des séquences d'ADN régulatrices, que l'on a considérées pendant longtemps comme des déchets génétiques.
Or, ces parties non codantes jouent en réalité un rôle essentiel dans de nombreuses pathologies.
A l'avenir, CRISPR-Cas9 pourrait servir à mieux caractériser le rôle encore largement méconnu de ces fragments d'ADN.
Ce qui est en cours
CRISPR-Cas9 : une "success story" en plusieurs étapes
1987. Un chercheur de l'université d'Osaka repère des séquences d'ADN un peu particulières dans le génome de bactéries Escherichia coli.
Dans certaines parties de ces séquences, les quatre lettres constitutives de l'ADN - adénine (A), guanine (G), cytosine (C) et thymine (T) - forment des suites immédiatement suivies des mêmes suites en sens inverse : elles peuvent donc se lire dans les deux sens, formant ainsi des palindromes. Ne sachant pas vraiment à quoi elles peuvent servir, ces énigmatiques séquences n'intéressent personne dans un premier temps.
La recherche se poursuit.
2002. L'acte de baptême : ces séquences sont appelées CRISPR pour Clustered Regularly Interspaced Short Palindromic Repeats.
2005. Une découverte supplémentaire : les morceaux d'ADN intercalés entre ces palindromes sont souvent des morceaux d'ADN de virus capables d'infecter des bactéries.
2007. L'agro-alimentaire s'en mêle : des chercheurs de l'entreprise danoise Danisco découvrent que, parmi les bactéries Streptococcus thermophilus utilisées pour fabriquer des yaourts et des fromages, celles qui ont des séquences CRISPR survivent mieux aux infections virales.
Les bactéries semblent en effet garder en mémoire dans leurs séquences CRISPR, l'ADN des virus les ayant préalablement infectées, ce qui leur permet de les repérer et de les combattre.
Au cours des cinq années suivantes, les travaux de différents laboratoires permettent de comprendre que les ADN viraux des séquences CRISPR sont recopiés en plus petites molécules nommées ARN qui s'attellent à une enzyme nommée Cas9. Dans la bactérie, si un ARN viral CRISPR associé à Cas9 croise un virus à l'ADN correspondant, il s'apparie à cet ADN.
Une fois l'accrochage effectué, la protéine Cas9 élimine le virus en découpant les deux brins de son ADN.
2012. Eurêka ! L'Américaine Jennifer Doudna de l'université californienne Berkeley, et la microbiologiste française Emmanuelle Charpentier de l'université suédoise d'Umea, ainsi que les chercheurs de l'entreprise Danisco, démontrent que l'ARN viral peut être remplacé par n'importe quelle séquence d'intérêt et que la simple association entre l'ARN CRISPR et la protéine Cas9 permet de couper l'ADN correspondant.
Le système CRISPR-Cas9 constitue donc une formidable équipe de détection d'une séquence d'ADN particulière, et une paire de ciseaux redoutable et précise. La porte est ouverte à la détermination de la fonction d'un gène choisi, à sa suppression et à son remplacement.
2013. Premier succès sur des gènes humains : des équipes réussissent à supprimer des gènes dans des cellules humaines. La technique est appliquée à toutes sortes de cellules et d'organismes : riz, mouche, poisson-zèbre...
2013-2018. Recherches tous azimuts : la technique est même modifiée pour que la protéine Cas9 ne coupe pas le gène ciblé mais stimule son expression.
A l'été 2014, c'est à une maladie génétique incurable que s'attaquent les chercheurs : la myopathie de Duchenne, une dégénérescence musculaire due à des mutations sur le gène codant pour la protéine indispensable au bon fonctionnement des fibres musculaires.
Ils parviennent à corriger cette mutation dans des embryons de souris, puis les réimplantent dans des mères porteuses. Neuf mois après leur naissance, parmi ceux chez lesquels la correction avait touché au moins 40 % des cellules, les muscles étaient parfaitement normaux !
Une équipe du Massachusetts Institute of Technology utilise CRISPR-Cas9 pour corriger une maladie génétique incurable du foie : la tyrosinémie, causée par une mutation génétique sur un gène nécessaire pour dégrader l'acide aminé nommé tyrosine.
Chez des souris souffrant de cette pathologie, CRISPR-Cas9 a réussi à remplacer le gène déficient par sa forme saine dans environ 0,5 % des cellules du foie (hépatocytes). Au bout d'un mois, ces cellules redevenues saines avaient proliféré : elles représentaient un tiers de tous les hépatocytes.
Des chercheurs californiens ont réussi à améliorer la vision chez des rats atteints d'une forme de cécité d'origine héréditaire. Les essais précliniques et aussi cliniques se multiplient chaque jour davantage.
Ce qu'il faut dépasser
Dépasser la barrière des anticorps
De 65 à 79 % de la population posséderait des anticorps contre les protéines de type CRISPR-Cas9. Et 46 % de la population possèderait aussi des globules blancs spécifiquement dirigés contre ces protéines.
Ces résultats émanent d'une étude prépubliée en janvier 2018 et conduite par des chercheurs de l'université de Stanford, en Californie.
Dépasser l'effet off-target
Il est certes très facile de cibler un gène spécifique avec CRISPR-Cas9, mais cela peut entraîner d'autres modifications non désirées en d'autres endroits du génome.
Ainsi, pour une modification souhaitée avec l'enzyme Cas9, les chercheurs peuvent se retrouver avec des dizaines de modifications "off-target" (hors-cible).
C'est notamment ce qui était arrivé en 2015 lorsque l'équipe de Junjiu Huang, généticien de l'université Sun Yat- sen dans la province du Guangdong (Chine), avait modifié des embryons humains pour supprimer le gène responsable de la bêta-thalassémie, une maladie du sang.
Des améliorations du système CRISPR-Cas9 permettant de diminuer ces effets indésirables ont déjà été décrites et de nombreux laboratoires, continuent d'y travailler.
Pouvoir estimer les conséquences éthiques, génétiques et environnementales de CRISPR-Cas9
• Un premier enjeu. Fin mars 2017, une équipe de recherche chinoise est parvenue pour la première fois à modifier le génome d'embryons humains viables grâce à la technique CRISPR-Cas9. Non seulement c'est la première fois que l'on modifie des embryons "normaux" ,mais dans ces travaux, les effets indésirables semblent moindres par rapport à ceux qui avaient été décrits précédemment dans des travaux équivalents mais sur des embryons non viables.
Si la technologie CRISPR est déjà extrêmement utile dans le domaine biomédical, le problème se pose en matière de modification de cellule germinale (gamètes par exemple) dont les mutations sont transmissibles. Ces modifications sont strictement interdites par la Convention d'Oviedo, dans son article 13, concernant les interventions sur le génome humain.
En revanche, la technique CRISPR-Cas9 utilisée pour modifier des cellules somatiques, comme par exemple des cellules CAR-T, des lymphocytes T modifiés, ne pose pas de problèmes spécifiques autres que ceux classiques de sécurité et d'efficacité des cellules modifiées.
La technique ne posera pas plus de problèmes dans les cellules somatiques avec l'évolution de Cas9 qui ne coupera plus la séquence génétique mais sera une sorte de radeau d'ancrage à une enzyme qui de, façon ciblée, corrigera la mutation sur site.
• Un deuxième enjeu. L'édition du génome des moustiques est une solution étudiée pour éradiquer des maladies telles que le paludisme.
Mais les scientifiques craignent que cette méthode échappe au contrôle et menace la biodiversité.
L'utilisation de CRISPR permet de créer une nouvelle espèce de moustiques, qui pourrait remplacer les espèces de moustiques porteuses du virus Zika, de la dengue ou du paludisme.
Une analyse d'impact est nécessaire. L'éradication de populations de moustiques pourrait perturber la biodiversité et bouleverser la chaîne alimentaire.
Des gènes modifiés du moustique pourraient être transmis à des insectes voisins et donc stériliser des espèces vitales pour l'homme, comme les abeilles.
Car la stratégie est de libérer des moustiques stériles dans la faune pour diminuer la population : des accouplements se feront ainsi avec des insectes stériles empêchant la reproduction. Ces derniers meurent rapidement, il faut donc en relâcher régulièrement pour continuer à faire diminuer la population.
Comment arrêter une réaction en chaîne dans la nature si on constate des effets négatifs ?
Fiche réalisée avec l'appui de Carine Giovannangeli, directrice adjointe de l'institut Bases moléculaires et structurales du vivant. CNRS-Inserm-Museum d'histoire naturelle.
Extrait de Santé 2030 - Partie 2 : les vecteurs d'innovation.
Retrouvez l'intégralité de l'étude sur le site.

