Le microbiote
De quoi parle-t-on ?
Le microbiote intestinal contient la plus importante communauté bactérienne du corps humain, composée de 1013 bactéries, localisées principalement dans 'intestin grêle et le côlon.
Le microbiote intestinal en chiffres
1013 bactéries
virus et surtout phages (n'infectant que les bactéries), champignons
De 300 à 500 espèces
par individu parmi un total de 1 500 à 2 000 espèces répertoriées dans les fèces humaines
De 500 000 à 600 000 gènes
bactériens par individu au sein d'un catalogue répertorié de plus 10 millions de gènes bactériens (à comparer aux 22 000 gènes du génome humain)
Bactéries symbiotiques du corps humain
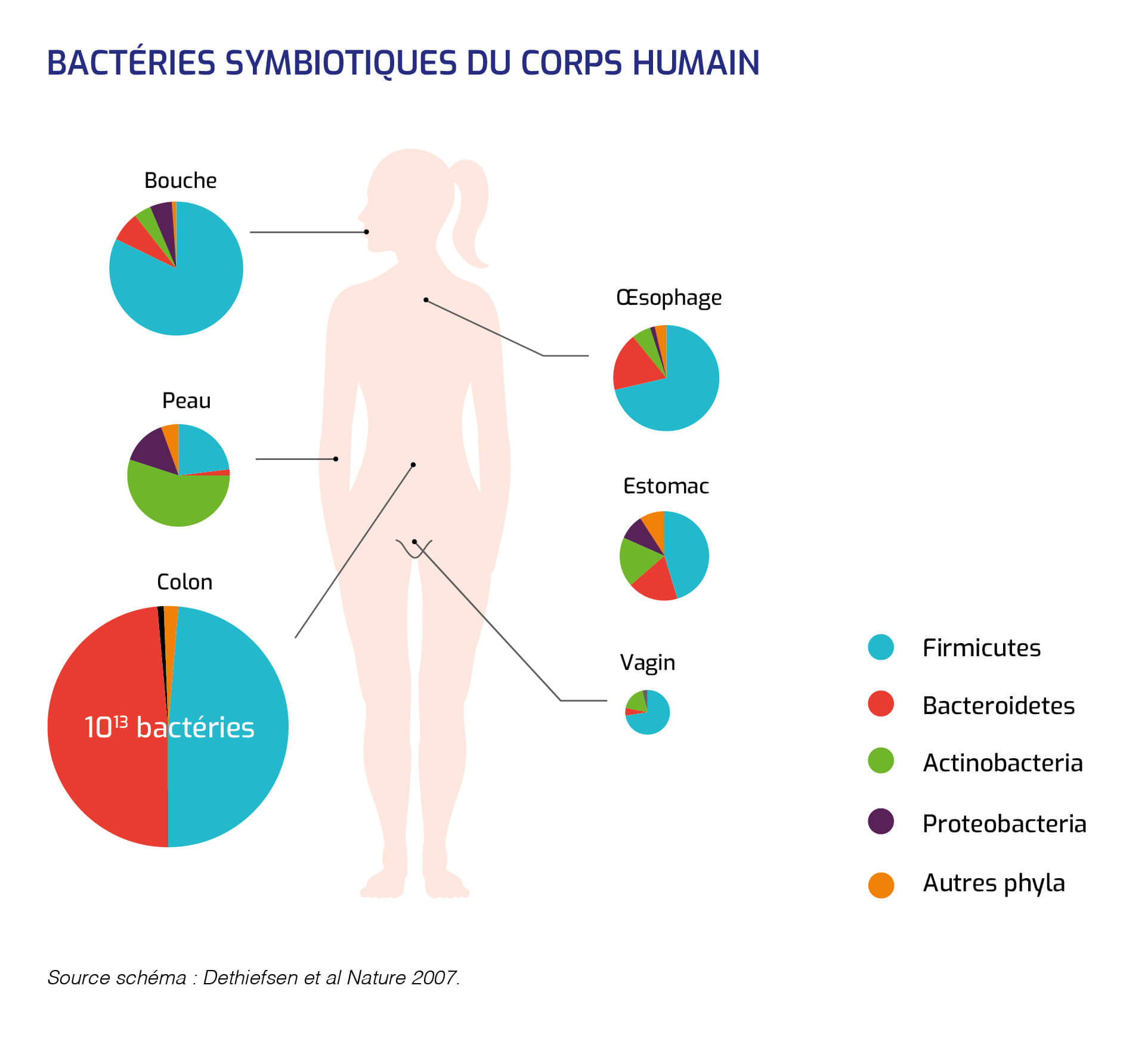
Parmi les nombreux gènes bactériens collectivement codés par le microbiote, un noyau de gènes toujours présents est considéré nécessaire à l'adaptation des bactéries dans l'écosystème digestif.
Mais il existe aussi un très grand nombre de gènes représentés de façon diverse entre individus.
Leur rôle individuel précis reste largement énigmatique, mais il est désormais admis que certains exercent des fonctions importantes pour l'hôte.
De multiples études expérimentales s'appuyant sur l'éradication du microbiote ont en effet montré que celui-ci influence de façon considérable la physiologie de son hôte et le développement de nombreuses pathologies.
Dans l'intestin, outre un rôle de barrière contre les microbes pathogènes, reconnu depuis plus de soixante ans, le microbiote joue un rôle essentiel dans la digestion des carbohydrates non digestibles.
Dans et à distance de l'intestin, le microbiote module le fonctionnement du système immunitaire et le métabolisme de son hôte, avec des effets qui affectent de multiples organes (intestin, foie, poumons, reins, cerveau), ainsi que les os et le système cardiovasculaire, comme le démontrent plusieurs études récentes.
De ce fait, il a été proposé que l'hôte et son microbiote forment un superorganisme.
De plus en plus d'études montrent une corrélation entre la diversité du microbiote, le mode de vie et la survenue de pathologies inflammatoires ou métaboliques chroniques.
Ainsi, la diversité en espèces, et donc en gènes microbiens, est réduite chez les individus atteints d'une pathologie chronique, comparée à celle de sujets en bonne santé.
Une réduction de la diversité du microbiote intestinal est aussi observée chez les humains vivant dans les pays industrialisés. Elle est plus diversifiée chez ceux qui ont conservé une alimentation et un mode de vie traditionnels.
Les travaux expérimentaux montrant qu'il est possible, chez l'animal, de transférer une maladie chronique ou une prédisposition à cette maladie.
Des expériences menées avec le microbiote des patients suggèrent que les modifications du microbiote, associées à l'industrialisation, pourraient être à l'origine de l'épidémie de maladies chroniques qui accompagnent ce changement de mode de vie.
Hôte & microbiote : un superorganisme
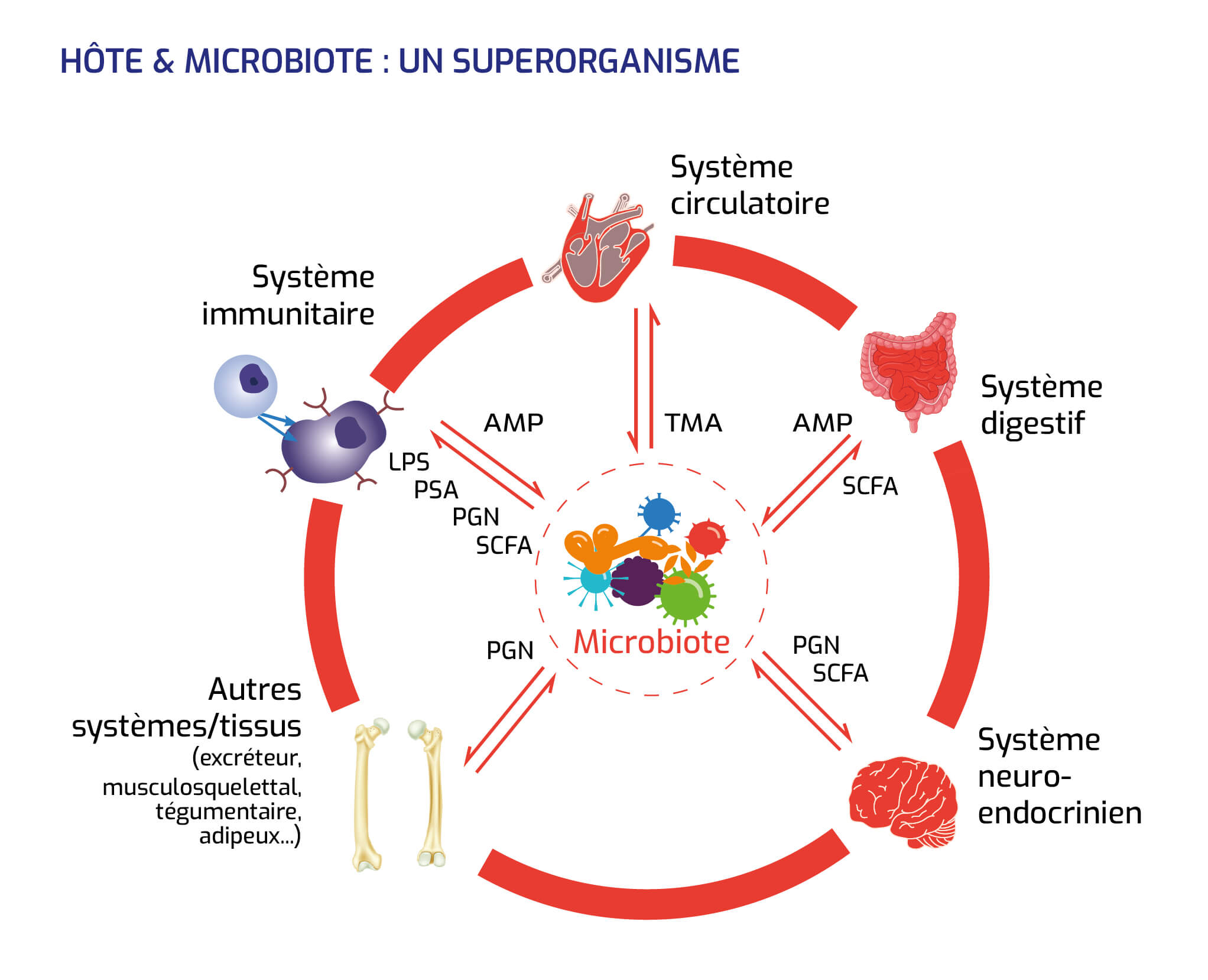
Les " quorum signals " sont des signaux moléculaires envoyés par les bactéries à leurs congénères.
Les acronymes AMP, LPS, PGN, SCFA, TMA désignent des métabolites, c'est-à-dire des produits intermédiaires qui se forment dans l'organisme au cours d'un processus métabolique.
Deux questions se posent donc, déterminant les recherches actuelles sur le microbiote :
1. Quels facteurs influencent la composition du microbiote : certaines modifications au cours de la vie, l’alimentation, les antibiotiques ?
2. Quels sont les effets du microbiote sur l’hôte et quels sont les mécanismes impliqués ?
Ce qui se profile d'ici 2030
Des pistes thérapeutiques prometteuses, utilisant les études sur la composition du microbiote et ses effets sur son hôte
• Le microbiote intestinal jouant un rôle clé à distance sur le métabolisme et le système immunitaire, via ses métabolites, peut donc influencer la réponse aux traitements. Le métabolisme de certains médicaments, dont la digitaline, des anticancéreux et les statines, pourrait être modifié par la composition du microbiote. On peut donc penser qu'à terme, les interventions thérapeutiques pourraient être déterminées en fonction de la composition du microbiote.
• L'analyse du microbiote pourrait devenir un outil de stratification des patients, permettant de surveiller l'évolution de la maladie (par exemple, les maladies inflammatoires chroniques intestinales) et l'état de santé des patients. On pourrait aussi stratifier les répondeurs et les non répondeurs aux traitements.
De nouvelles façons d’appréhender et de prédire le rôle de micro-organismes du microbiote en santé et en pathologie humaine par des approches d'intelligence artificielle, intégrant les données issues de l'analyse ” multiomique ” des patients d'une part, et du microbiote d'autre part.
Un nouveau regard sur la naissance, issu de nombreuses preuves cliniques et expérimentales, montrant combien la manière dont le microbiote s'implante dans les premiers mois de vie est cruciale pour le développement de l'enfant et sa santé future. Un retard ou une modification dans cette implantation pourrait expliquer l'apparition de pathologies chroniques plus tardives, comme les allergies, les maladies inflammatoires intestinales, l'obésité et le syndrome métabolique.
Ce qui est en cours
Une identification des facteurs influençant la composition du microbiote
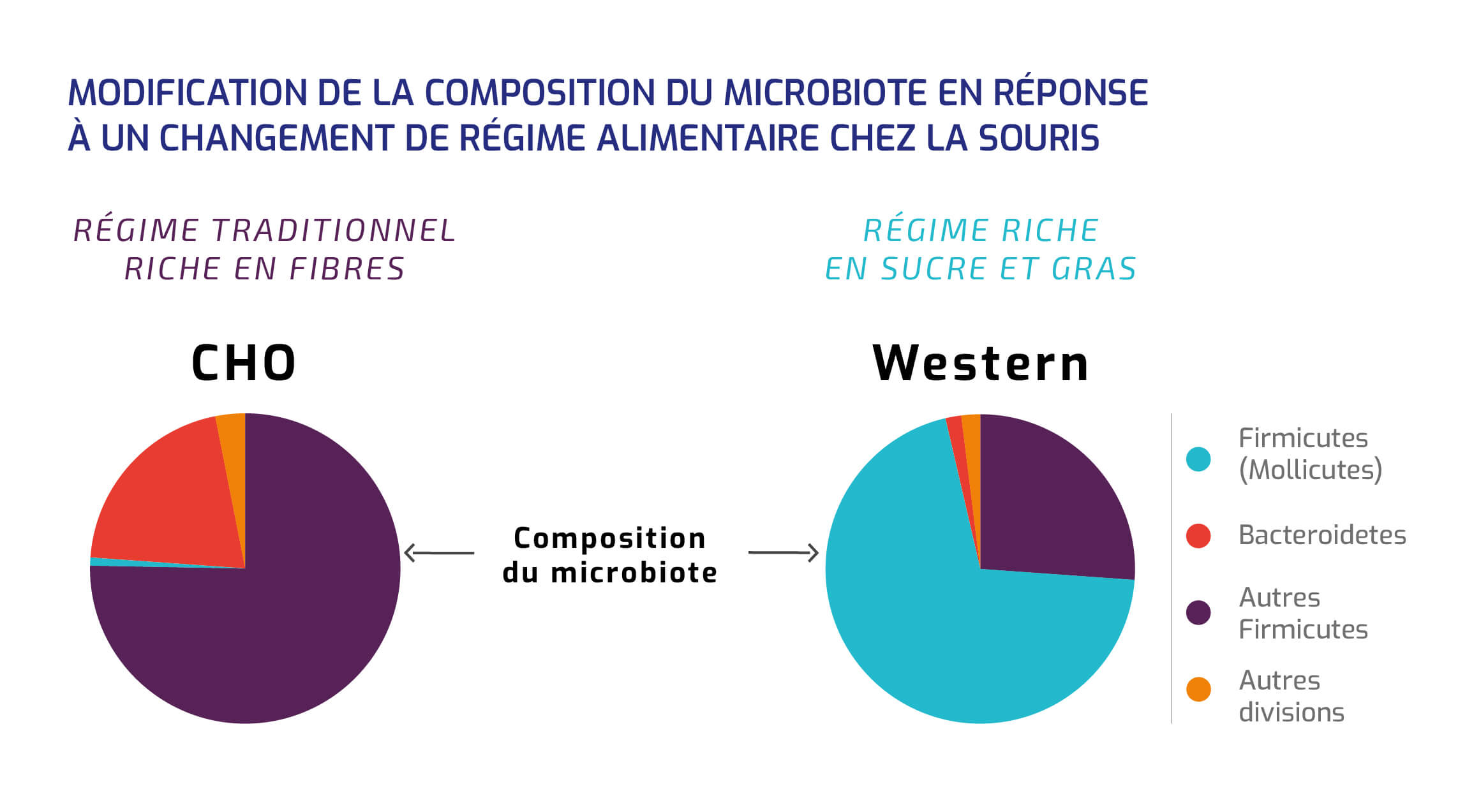
L’ALIMENTATION
La composition du microbiote évolue en effet selon l'alimentation de l'hôte, comme le montre le changement de la composition du microbiote d'une souris après un régime alimentaire riche en sucres et en gras.
Modification de la composition du microbiote en réponse à un changement de régime alimentaire chez la souris
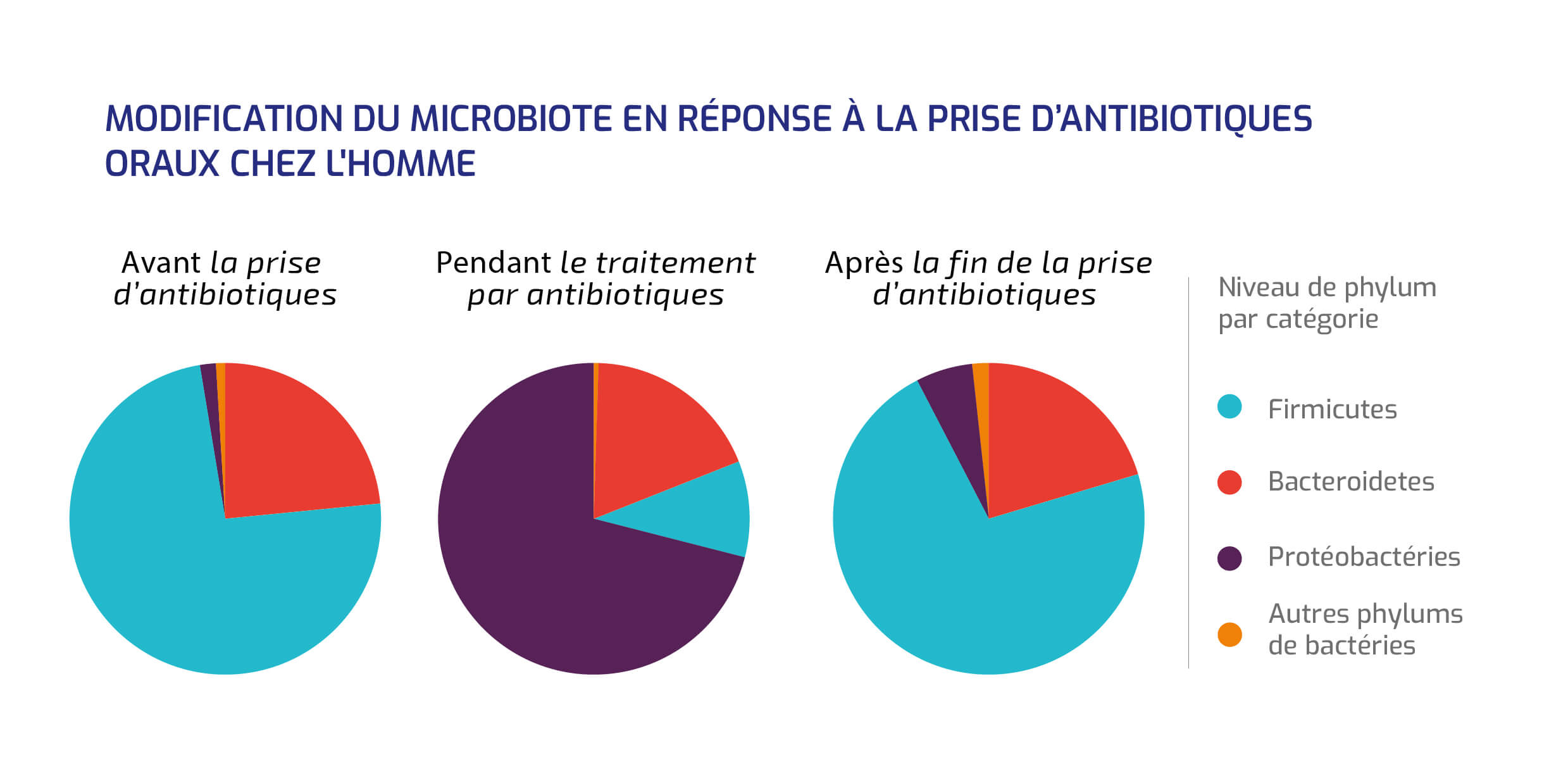
LA PRISE D’ANTIBIOTIQUES
Elle varie aussi en fonction de la consommation d'antibiotiques.
Modification du microbiote en réponse à la prise d'antibiotiques oraux chez l'homme
La composition du microbiote est très dynamique et est influencée par l'environnement dans lequel vit l'hôte, les microbiotes du sol, des animaux...
Elle garde pourtant une part ” stable ” donnée par les niches microbiennes, constituées entre 0 et 3 ans.
Développement du microbiote intestinal après la naissance
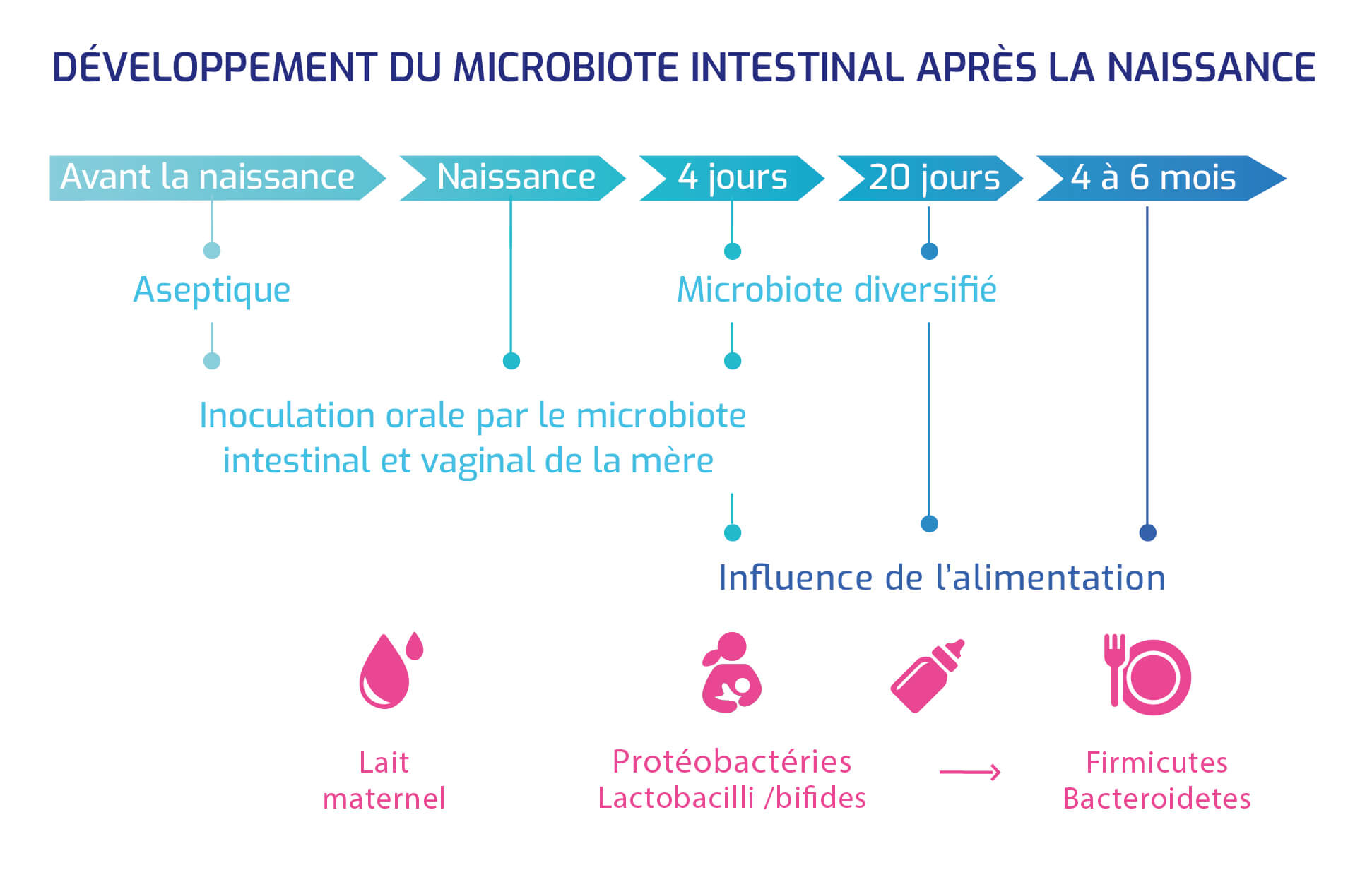
Une identification précise des fonctions du microbiote
• Le microbiote intestinal contribue à la digestion de nos aliments et à notre métabolisme. Les bactéries du côlon sont en particulier équipées d'enzymes capables de dégrader les carbohydrates complexes d'origine alimentaire non digestibles par les enzymes intestinaux.
La dégradation par les bactéries intestinales de ces molécules, communément appelées fibres alimentaires, conduit à la formation des acides gras à chaîne courte volatils, dont les plus abondants sont l'acétate, le propionate et le butyrate.
Le butyrate est le substrat énergétique utilisé par les cellules épithéliales tapissant la paroi du côlon. Son utilisation par les cellules coliques s'accompagne d'une consommation très importante d'oxygène, qui limite la diffusion de ce gaz dans la lumière de l'intestin, maintenant de ce fait des conditions propices à la croissance des bactéries productrices de butyrate.
• Ainsi, il se crée un cercle vertueux : les bactéries digèrent des sucres complexes apportés par notre alimentation, libérant des métabolites bactériens qui assurent la survie de nos cellules coliques.
En retour, le métabolisme de ces cellules crée des conditions favorables aux bactéries produisant ces métabolites. C'est un exemple de la symbiose établie entre les bactéries intestinales et l'hôte.
• Le microbiote intestinal est également capable de fabriquer des molécules indispensables à notre survie, comme les vitamines B12 ou K, de moduler l'absorption des sucres et des lipides, de transformer les acides biliaires secondaires en des métabolites qui ont une influence sur notre métabolisme glucido-lipidique. Il a été estimé que 10 % de notre énergie quotidienne est fournie par notre microbiote intestinal.
• La présence du microbiote assure une protection efficace contre la colonisation par des bactéries pathogènes. Cet effet barrière s'appuie sur un ensemble de mécanismes complexes, incluant la compétition entre bactéries commensales et pathogènes pour les mêmes substrats énergétiques, la production par les bactéries commensales de substances antibiotiques bloquant la croissance d'autres bactéries, la stimulation par les bactéries commensales des défenses immunitaires de leur hôte.
• En effet, les bactéries du microbiote façonnent notre système immunitaire. Elles induisent simultanément des signaux qui stimulent nos défenses anti-infectieuses et d'autres signaux qui évitent un emballement excessif de ces réponses, source d'inflammation et de destruction tissulaire.
Ces effets du microbiote s'exercent dans l'intestin, dont ils renforcent la fonction de rempart contre l'entrée des bactéries intestinales. Ils s'exercent aussi sur le système immunitaire à distance de l'intestin, renforçant par exemple, au niveau du poumon, la protection vis-à-vis des infections bactériennes et virales, tout en limitant les réponses allergiques des effets qui sont néanmoins variables selon la composition du microbiote.
• Les voies de signalisation activées par le microbiote sont l'objet de très nombreuses études. Dans l'intestin, ces signaux peuvent être la conséquence d'un contact direct entre bactéries et cellules de l'hôte. Néanmoins, la majorité des bactéries commensales présentes dans l'intestin sont enveloppées dans un film de mucus qui les retient prisonnières à distance de l'épithélium.
En revanche, les micro-organismes produisent en abondance de nombreux métabolites pouvant induire des signaux localement dans la muqueuse, mais aussi à distance, après avoir diffusé à travers le sang et la lymphe.
Certains métabolites peuvent aussi agir en activant des relais dans le système nerveux.
Un enjeu considérable est aujourd'hui de répertorier parmi les métabolites produits par le microbiote ceux qui ont des effets sur l'hôte, de cerner les signaux induits et les conséquences pour l'hôte, ainsi que d'identifier les espèces particulières impliquées dans leur production et les mécanismes régulant leur production dans l'intestin.
Les effets biologiques déjà observés sont en effet considérables, concernant la régulation de l'inflammation, du métabolisme glucido-lipidique, du comportement, de la satiété ou de la douleur, par exemple.
Ces travaux permettent d’envisager le développement de nouveaux biomarqueurs issus du métabolisme bactérien ou fondés sur la quantification de bactéries spécifiques.
Le microbiote accessible dans les échantillons fécaux pourrait donc être la source de nouveaux biomarqueurs de diagnostic ou d’espèces bactériennes utilisables à des fins thérapeutiques. La bactérie Faecalibacterium prausnitzii, et un ensemble de souches de Clostridium capables d’exercer des effets antinflammatoires, sont des exemples de ces nouveaux probiotiques.
Enfin, récemment, la transplantation de selles a été reconnue comme un médicament en France. Le principe est d'inoculer des selles humaines provenant d'un individu sain (le donneur) à un malade (le receveur).
La seule indication acceptée actuellement concerne les diarrhées à Clostridium difficile résistant aux antibiotiques, dont l'efficacité initialement mise en évidence par une équipe néerlandaise est confirmée.
Plusieurs essais cliniques sont en cours pour tester la transplantation fécale dans d'autres pathologies, comme la maladie de Crohn, le syndrome de l'intestin irritable ou les maladies du foie.
Les résultats des premières études publiées pour la rectocolite hémorragique, une maladie inflammatoire de l'intestin, sont encourageants, mais très loin du taux de succès observé avec l'infection à Clostridium difficile.
• Aujourd'hui, d'autres approches sous forme de gélules sont en cours de mise au point.
De nombreux problèmes d'efficacité et de sécurité sont à résoudre. S'il est vraisemblable que les souches transplantées vont pouvoir s'implanter dans l'intestin d'un patient ayant développé un Clostridium difficile du fait d'une antibiorésistance qui a éliminé sa propre flore, implanter durablement de nouvelles souches chez un individu avec un microbiote constitué n'est pas une opération simple.
La caractérisation de microbiotes associés à la santé ou à des pathologies, mais aussi nos connaissances sur les fonctions du microbiote, nous imposent d'envisager l'hôte, homme ou animal, de façon intégrée et de développer une approche écologique de notre santé.
Ce qu'il faut dépasser
Le microbiote apparaît être un écosystème d'une complexité bien supérieure à celle imaginée.
Les outils nécessaires à la compréhension de cet écosystème complexe ne sont pas tous en place, et un important travail doit être mené pour rationnaliser ces informations.
Des méthodes sont en cours d’élaboration pour étudier le microbiote
La qualité des méthodes et des outils utilisés va permettre de comprendre comment les microbes et les cellules humaines interagissent, afin de découvrir de nouveaux métabolites, des cibles moléculaires originales et de se lancer dans des expériences thérapeutiques.
Les hypothèses : il s’agit de faire la preuve d’un lien de causalité entre les modifications du microbiote et certaines maladies
Ainsi, le rôle du microbiote est largement évoqué dans plusieurs maladies neuropsychiatriques : l'autisme, l'anxiété et la dépression.
D'autres études ont suggéré un rôle important du microbiote dans les maladies neurodégénératives : il serait impliqué dans l'inflammation cérébrale de la maladie d'Alzheimer en participant à la formation des plaques amyloïdes. Des études très récemment publiées ou en cours suggèrent des pistes précises impliquant des métabolites produits par certaines souches bactériennes.
La faculté du microbiote d’opposer une résistance aux changements
Il peut en effet gêner les tentatives de manipulation thérapeutique. Il reste un travail très précis à effectuer pour comprendre les mécanismes qui contrôlent la composition du microbiote, afin de pouvoir le manipuler en minimisant les risques. De plus en plus de chercheurs se penchent sur cette question.
L’insuffisant développement d’un écosystème dédié à la recherche et à la mise au point de nouveaux traitements à partir du microbiote
La France est bien placée grâce à certains laboratoires de recherche spécialisés, qui ont joué un rôle déterminant dans la description du microbiote en situation normale et pathologique et l'identification de souches d'intérêt.
Néanmoins, d'importants efforts doivent encore être entrepris pour partager des bases de données et des procédures standardisées entre acteurs de la recherche, mettre en place et rationnaliser les outils et les plateformes nécessaires aux études mécanistiques, créer les approches bio-informatiques indispensables à l'intégration et l'interprétation de la masse des données générées, et, enfin, développer des start-up capables de qualifier des biomarqueurs et de mettre au point des solutions thérapeutiques maîtrisées, basées sur l'implantation de bactéries particulières et les transferts fécaux.
Fiche réalisée avec l'appui de Nadine Cerf-Bensussan, directrice de recherche Inserm. UMR S1163. Laboratoire d'immunité intestinale. Institut Imagine.
Extrait de Santé 2030 - Partie 2 : les vecteurs d'innovation.
Retrouvez l'intégralité de l'étude sur le site.

