Une validation administrative très réglementée

L'activité de l'industrie du médicament s'exerce dans un cadre fixé par les Codes de la Santé Publique et de la Sécurité Sociale. Il faut distinguer le circuit réglementaire des médicaments remboursables de celui des médicaments vendus aux hôpitaux.
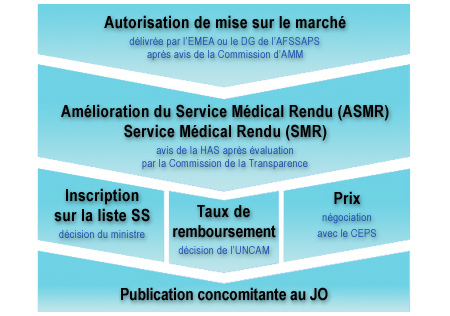
Circuit réglementaire des médicaments remboursables
Circuit réglementaire des médicaments vendus aux hôpitaux

La fabrication, l'importation, l'exportation, la distribution en gros de médicaments ainsi que l'exploitation des spécialités pharmaceutiques ne peuvent être effectuées que dans des établissements pharmaceutiques dont l'ouverture est subordonnée à une autorisation délivrée par l'ANSM ou par le Ministère de la Santé.
Par ailleurs, un médicament ne peut être commercialisé que s'il a reçu de l'ANSM, une Autorisation de Mise sur le Marché (AMM), ce qui signifie qu'ont été réalisées les études qui ont permis de s'assurer de sa qualité, de sa sécurité et de son efficacité.
Postérieurement à la délivrance de l'AMM, la pharmacovigilance a pour objet la surveillance du risque d'effet indésirable résultant de l'utilisation des médicaments mis sur le marché. La prévention d'un risque d'effet indésirable peut conduire dans de rares cas à un retrait du marché de la spécialité concernée.

