Le médicament et sa mise au point
Quel est le rôle de la recherche clinique ?
Pratiquée en partenariat avec les hôpitaux, elle contribue au niveau élevé d’expertise médicale des professionnels hospitaliers en France.
(Maj : 12.05.2022)
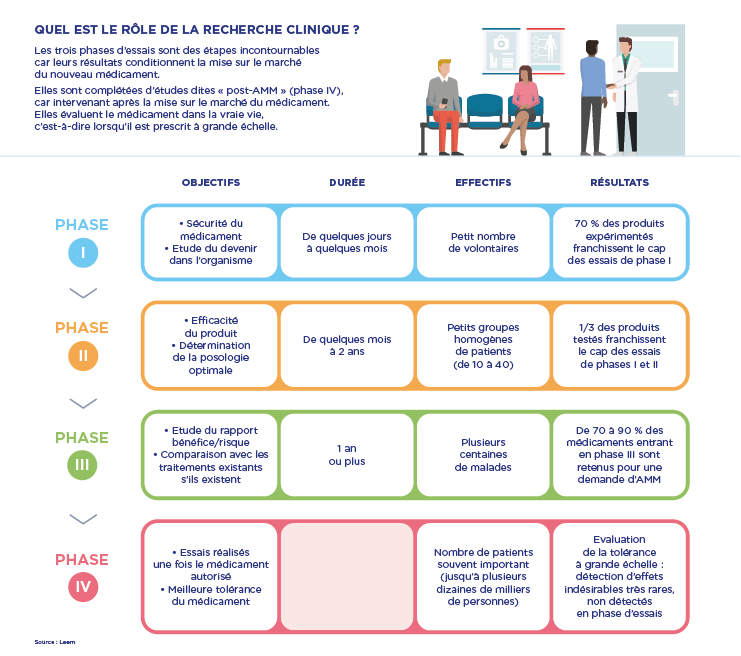
● Les essais cliniques sont la phase « pivot » du développement d’un médicament : après les phases de recherche en laboratoire et sur les animaux (phase préclinique), qui permettent de déterminer l’activité d’un produit et sa toxicité, des études cliniques, c’est-à-dire réalisées chez l’homme, sont organisées.
Leurs objectifs : évaluer et préciser la sécurité d’emploi (phase I), le devenir du produit dans l’organisme et confirmer l’efficacité thérapeutique de la molécule sur une maladie donnée (phases II et III).
● Les essais cliniques sont conduits après avis favorable d’un comité d’éthique, appelé Comité de protection des personnes (CPP), et une autorisation de l’Agence nationale de sécurité du médicament et des produits de santé (ANSM).
● Le patient est au cœur de l’essai : l’information des sujets ou des patients que l’on se propose d’inclure dans les essais est un élément capital de la protection de ces personnes, validée par le CPP.
Tout patient susceptible de s’engager dans un protocole d’essai clinique doit signer un document dit de « consentement éclairé » garantissant qu’il a reçu de la part du médecin investigateur (ou de son représentant) toutes les informations concernant :
o les bénéfices attendus de la recherche ;
o les contraintes et les risques prévisibles, y compris en cas d’arrêt de la recherche avant son terme ;
o le droit au refus de participer ;
o la possibilité de retrait de son consentement à tout moment sans encourir aucune responsabilité ni aucun préjudice.
● Le patient participe à l’évaluation de son traitement et a le droit de l’interrompre à tout moment.
● La recherche clinique est une étape clé du progrès médical.
● Les essais cliniques construisent le « disque dur » du nouveau médicament : parce qu’ils sont réalisés sur l’homme, ils contribuent à créer un médicament efficace et sûr à partir des données accumulées dans cette étape d’apprentissage.
● Conduits sur le sol français, les essais cliniques y maintiennent la chaîne d’expertise de la R&D pharmaceutique, et font ainsi profiter les patients des soins les plus prometteurs le plus tôt possible.
● Les entreprises du médicament participent à l’encadrement et à la sécurité des essais cliniques sur le territoire français : tous les essais sont soumis au respect des bonnes pratiques cliniques (BPC). En application de ces dernières, toute recherche biomédicale doit faire l’objet de contrôles de qualité réalisés en début et en cours d’essai sous la responsabilité du promoteur de la recherche. Cette fonction est en général assurée par les assistants de recherche clinique (ARC) du promoteur.
● Les entreprises du médicament s’adaptent aux modifications entraînées par le règlement européen sur les essais cliniques (CTR), qui est entré en vigueur en janvier 2022.
● Les entreprises du médicament veillent à la bonne information du grand public sur la recherche clinique grâce au site régulièrement actualisé notre-recherche-clinique.fr