Biosimilaires : des médicaments comme les autres ?
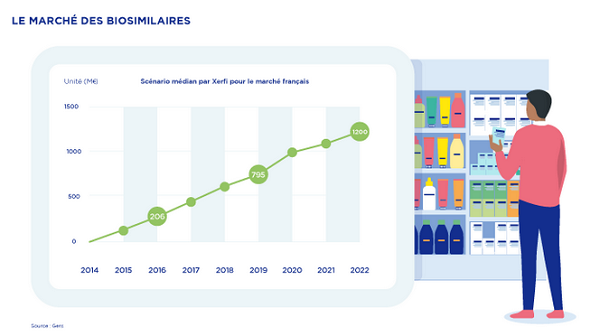
Le marché des biosimilaires se développe très rapidement, à l’hôpital notamment.
Un médicament biosimilaire est similaire à un médicament biologique de référence qui a été autorisé en Europe depuis plus de huit ans et dont le brevet est tombé dans le domaine public. Pour rappel, l’insuline, les vaccins, les anticorps monoclonaux et les hormones de croissance sont quelques-uns des médicaments biologiques.
● En 2018, 18 nouveaux médicaments biosimilaires ont été inscrits sur la liste de référence de l’Agence nationale de sécurité du médicament et des produits de santé (ANSM).
Le marché est principalement soutenu par la pénétration croissante de 4 nouvelles molécules lancées en 2018, dont l’adalimumab (traitement des arthrites juvéniles, de la maladie de Crohn, de la polyarthrite rhumatoïde, du psoriasis, etc.).
● Contrairement à un médicament générique, le médicament biosimilaire n’est pas strictement identique au produit biologique de référence. Il a néanmoins des caractéristiques de tolérance, de sécurité et d’efficacité clinique très proches du produit de référence, ce qui permet de le considérer comme « similaire ».
A l’instar des médicaments génériques, il se distingue par son prix inférieur, son nom de marque et son emballage différents (couleur, présentation…).
● Mais un médicament biosimilaire ne peut pas être assimilé à un médicament générique : les matières premières utilisées, les procédés de production, les modes d’action, les procédures d’autorisation de mise sur le marché sont différents.
Par ailleurs, les réactions biologiques aboutissent à des produits qui doivent être étroitement contrôlés pour garantir une similarité entre le médicament biosimilaire et son biomédicament de référence.
● Ces différences s’expliquent par la grande complexité de fabrication des médicaments biologiques, comparativement aux médicaments chimiques.
Alors que ces derniers résultent d’une synthèse chimique simple, impliquent une cinquantaine de tests et contrôles avant leur commercialisation et sont stables dans le temps, les médicaments biologiques résultent de processus de fabrication complexes issus du vivant, impliquent en moyenne 250 tests et contrôles et sont très sensibles aux changements d’environnement.
Pour consulter la fiche, issue du "100 Questions" dans son intégralité :
https://www.leem.org/100-questions/biosimilaires-des-medicaments-comme-…

