Le médicament et son économie
Biosimilaires : des médicaments comme les autres ?
Le marché des biosimilaires se développe très rapidement, à l’hôpital notamment.
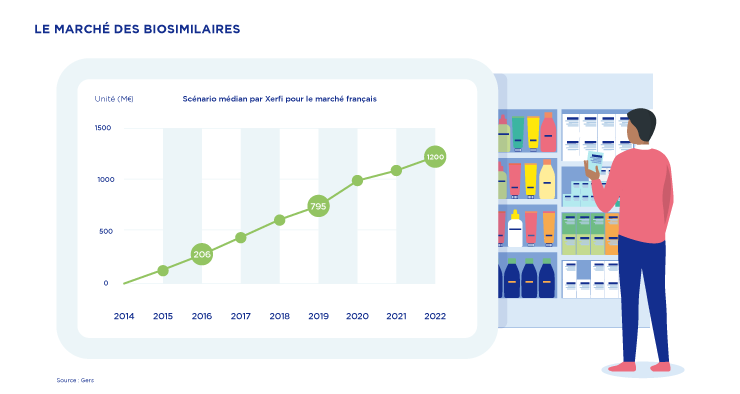
c'est le montant que pourrait dépasser le marché des biosimilaires en France en 2022, selon une étude du cabinet Xerfi (2)
Fin 2019, les ventes de biosimilaires se sont établies à 795 millions d’euros, soit une hausse de 50 % par rapport à 2018, pour représenter 34 % des médicaments biologiques.
● Un médicament biosimilaire est similaire à un médicament biologique de référence qui a été autorisé en Europe depuis plus de huit ans et dont le brevet est tombé dans le domaine public. Pour rappel, l’insuline, les vaccins, les anticorps monoclonaux et les hormones de croissance sont quelques-uns des médicaments biologiques.
● En 2018, 18 nouveaux médicaments biosimilaires ont été inscrits sur la liste de référence de l’Agence nationale de sécurité du médicament et des produits de santé (ANSM).
Le marché est principalement soutenu par la pénétration croissante de 4 nouvelles molécules lancées en 2018, dont l’adalimumab (traitement des arthrites juvéniles, de la maladie de Crohn, de la polyarthrite rhumatoïde, du psoriasis, etc.).
● Contrairement à un médicament générique, le médicament biosimilaire n’est pas strictement identique au produit biologique de référence. Il a néanmoins des caractéristiques de tolérance, de sécurité et d’efficacité clinique très proches du produit de référence, ce qui permet de le considérer comme « similaire ».
A l’instar des médicaments génériques, il se distingue par son prix inférieur, son nom de marque et son emballage différents (couleur, présentation…).
● Mais un médicament biosimilaire ne peut pas être assimilé à un médicament générique : les matières premières utilisées, les procédés de production, les modes d’action, les procédures d’autorisation de mise sur le marché sont différents.
Par ailleurs, les réactions biologiques aboutissent à des produits qui doivent être étroitement contrôlés pour garantir une similarité entre le médicament biosimilaire et son biomédicament de référence.
● Ces différences s’expliquent par la grande complexité de fabrication des médicaments biologiques, comparativement aux médicaments chimiques.
Alors que ces derniers résultent d’une synthèse chimique simple, impliquent une cinquantaine de tests et contrôles avant leur commercialisation et sont stables dans le temps, les médicaments biologiques résultent de processus de fabrication complexes issus du vivant, impliquent en moyenne 250 tests et contrôles et sont très sensibles aux changements d’environnement.
Source (1)
● La croissance du marché des biosimilaires repose sur la forte hausse de la demande des hôpitaux.
Pour le moment, il s’étend surtout à l’hôpital. Des expérimentations sont ainsi en cours dans 45 établissements hospitaliers pour l’insuline (diabète) et l’étanercept (traitement de la polyarthrite rhumatoïde et du psoriasis).
● En outre, le contexte est particulièrement prometteur car les biosimilaires constituent une source importante d’économies pour les pouvoirs publics : environ 1,2 milliard d’euros en France, selon le Comité économique des produits de santé (CEPS).
● La question de la substitution fait toujours débat. En 2016, l’ANSM avait estimé que tout échange non contrôlé entre médicaments biologiques (biosimilaires ou médicaments de référence) devait être évité.
Toutefois, elle considérait qu’une interchangeabilité pouvait être envisagée en cours de traitement par le médecin, sous réserve d’information et d’accord du patient, de traçabilité des produits concernés et d’une surveillance clinique appropriée.
● Les lignes ont bougé récemment sur cette question sensible puisque l’article 42 de la loi de financement de la Sécurité sociale (LFSS) pour 2020 supprime la possibilité de substitution d’un médicament biologique par son biosimilaire par le pharmacien, celle-ci étant jugée impossible à mettre en œuvre au moment de la délivrance, « notamment pour des questions de traçabilité et de sécurité sanitaire ».
Ce droit apparu dans la LFSS 2014 n’avait jamais été appliqué jusqu’à présent, faute de décret d’application.
Source (3)
● Les entreprises du médicament font entendre leur point de vue sur la substitution : en vue de garantir la confiance de tous les acteurs, à commencer par les patients, elles recommandent de confier au médecin prescripteur la responsabilité de la prescription des médicaments biologiques, qu’ils soient de référence ou biosimilaires.
● Les entreprises du médicament incitent par ailleurs les pouvoirs publics à dresser la liste de tous les médicaments biologiques – au-delà des seuls biosimilaires – afin de permettre une traçabilité effective de l’ensemble de ces produits.
Elles préconisent notamment une conservation des données relatives à ces prescriptions pendant trois ans dans le dossier pharmaceutique, contre quatre mois seulement pour les autres médicaments.
● Elles préconisent enfin de mener une large campagne d’information à destination de l’ensemble des acteurs concernés : médecins prescripteurs, pharmaciens et patients, afin de les sensibiliser aux spécificités des médicaments biologiques.