5e enquête Leem "Attractivité de la France pour les essais cliniques industriels"
40% des études internationales avec participation de l’Europe ont été proposés à la France durant la période 2008-2010 et 28% y ont été effectivement réalisés. En 2006, 70% de ces études étaient proposés à la France et 49% y étaient organisés.
Le nombre global d’essais cliniques réalisés en France, leur organisation, leur répartition par domaines et par phases sont autant d’indicateurs de la vitalité et de la compétitivité de la recherche clinique française et de sa position au sein de la recherche clinique internationale.
Ce sont ces indicateurs qui sont suivis par Les Entreprises du Médicament (Leem) dans une enquête inédite et d’une ampleur unique effectuée tous les deux ans depuis 2002 auprès des industriels internationaux de la pharmacie.
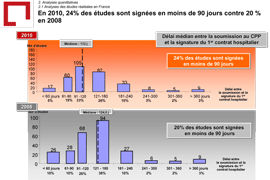
La dernière édition de cette enquête (2010) a porté sur près de 330 études internationales (avec participation française) de phase 2 et 3, incluant 250 000 patients. Il en ressort qu’au sein de la compétition internationale, la France parvient tout juste à maintenir sa position avec :
- 8% des patients recrutés
- 4,3 patients recrutés par centre actif en phase 2 et 7,8 en phase 3, un indicateur important de la performance française en recherche clinique (la moyenne européenne se situe à 4,4 en phase 2 et 9,2 en phase 3)
- 53% des études de phases précoces (phase 1 et 2)
- 75% des patients recrutés dans trois champs thérapeutiques, oncologie, anti infectieux/vaccins et cardiovasculaire/métabolisme : une reconnaissance de l’expertise française dans ces domaines.
Une mise en perspective des résultats de l’enquête sur une période plus longue montre cependant que la France a de plus en plus de mal à rester attractive : à côté des compétiteurs connus, l’Allemagne, les Etats-Unis, qui ont réussi à monter en puissance depuis 2006, des régions que l’on n’attendait pas aussi vite, s’avèrent de redoutables concurrents : l’Asie et l’Amérique Latine confirment leur percée tandis que les pays de l’Est continuent leur progression avec 22% de patients inclus dans les essais cliniques mondiaux contre 18% en 2008.
Ce constat d’érosion ne fait que confirmer l’urgence de se mobiliser pour soutenir et professionnaliser la recherche clinique en France. Les industriels du médicament explorent de nouvelles pistes :
- la prolongation des missions du CeNGEPS, (Centre national de gestion des produits de santé) jusqu’en 2015 : il a déjà en 4 ans réussi à financer 210 postes de personnels techniques en recherche à l’hôpital et à structurer 19 réseaux thématiques d’investigation clinique
- l’identification d’un modèle de centre d’excellence français modélisable qui pourrait aider d’autres centres à se structurer
- l’élaboration avec leurs partenaires hospitaliers d’un « kit standard » permettant de simplifier la phase de contractualisation des essais.
Les essais cliniques restent l’étape clé du développement d’un médicament :
- parce qu’ils sont réalisés sur l’homme, ils participent à la mise au point d’un médicament, efficace et sûr, à partir des connaissances accumulées dans ces phases d’apprentissage
- conduits sur le sol français, ils permettent aux patients de bénéficier des médicaments les plus prometteurs le plus tôt possible.et d’y maintenir la chaîne d’expertise de la R&D pharmaceutique.
Il est impératif de pérenniser le capital d’expertise française en recherche clinique et de l’étendre à d’autres champs thérapeutiques. C’est pourquoi Les Entreprises du Médicament appellent à une mobilisation des forces publiques et privées et à la multiplication des partenariats pour que la France reste un pays attractif pour la recherche clinique internationale. Il en va du traitement de nos malades, mais aussi de l’expertise de notre recherche et de notre future place dans l’économie des sciences du vivant.

