La thérapie génique
De quoi parle t-on ?
Les deux voies de la thérapie génique :
Deux approches existent : soit injecter directement le matériel génétique fonctionnel (solution d'ADN nu, liposomes ou vecteur viral) soit le multiplier d'abord en laboratoire dans des cellules mutées de l'organisme.
Ce qui se profile d'ici 2030
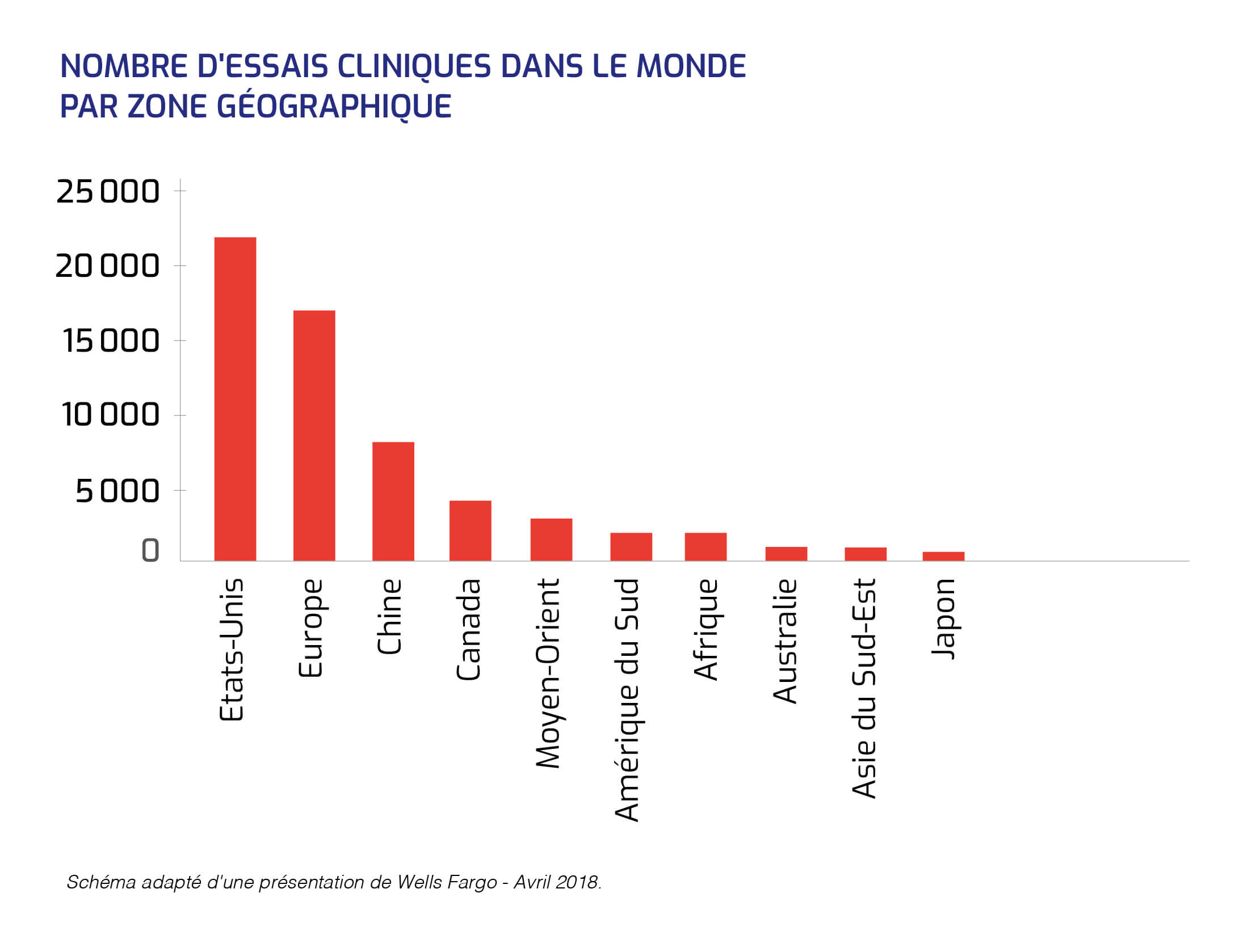
Les thérapies géniques sont en plein essor et les investissements industriels sont massifs dans ce champ.
On peut en effet développer aujourd'hui des vecteurs viraux capables de transférer des gènes de façon efficace et durable, que ce soit in vivo ou ex vivo.
Les progrès accomplis permettent de modifier de fond en comble le patrimoine génétique de ces virus : on peut ainsi les rendre les plus inoffensifs possibles, plus silencieux vis-à-vis du système immunitaire de l'hôte.
L'éventail des vecteurs est large : on y trouve des vecteurs non réplicatifs, intégratifs ou non intégratifs, viraux ou non, adaptés à différentes indications.
• Les vecteurs intégratifs, comme les rétrovirus et les lentivirus, permettent d'insérer un gène thérapeutique dans l'ADN de l'hôte, garantissant ainsi son maintien dans les cellules filles après divisions.
• Les vecteurs non intégratifs (adénovirus, AAV) permettent au contraire d'éviter l'intégration aléatoire du gène dans l'ADN de l'hôte.
• D'autres essais sont même tentés avec de l'ADN nu, directement injecté dans l'organisme.
Les vecteurs viraux AAV, dérivés du parvovirus humain adéno-associé, se sont imposés, en l'espace de trois décennies, comme des outils extrêmement puissants par leur simplicité et par leur capacité à infecter une grande variété de tissus in vivo.
Ce qui est en cours
Le premier essai de thérapie génique chez l'homme remonte à 1995 avec le traitement d'un patient atteint d'immunodéficience sévère (de type Ada SCID), grâce à l'injection de cellules souches et de lymphocytes génétiquement modifiés.
Un premier pas, transformé dans les années 2000 par un succès thérapeutique obtenu par l'équipe d'Alain Fischer auprès des enfants atteints d'une autre forme de déficit immunitaire (SCID de type X1).
La thérapie génique est souvent présentée comme un moyen de lutter contre des maladies monogéniques, c'est-à-dire liées au dysfonctionnement d'un seul gène, en injectant un gène sain pour remplacer un gène malade.
La réalité est tout autre : de nombreux essais de thérapie génique ont eu lieu dans le champ des maladies rares.
En 2016, un garçon âgé de 13 ans atteint de la drépanocytose a été traité avec succès par thérapie génique. Une première mondiale, réalisée par des médecins de l'hôpital Necker. L'adolescent, qui souffrait d'une forme particulièrement sévère de drépanocytose, a vu la disparition de ses symptômes, comme les crises douloureuses, l'anémie chronique, la fatigue et des atteintes aux articulations qui l'empêchaient parfois même de marcher. Ce succès représente un espoir thérapeutique pour les millions de personnes qui vivent avec la drépanocytose dans le monde.
Chaque année, en France, 480 bébés naissent avec cette maladie, dont les deux tiers en Ile-de-France.
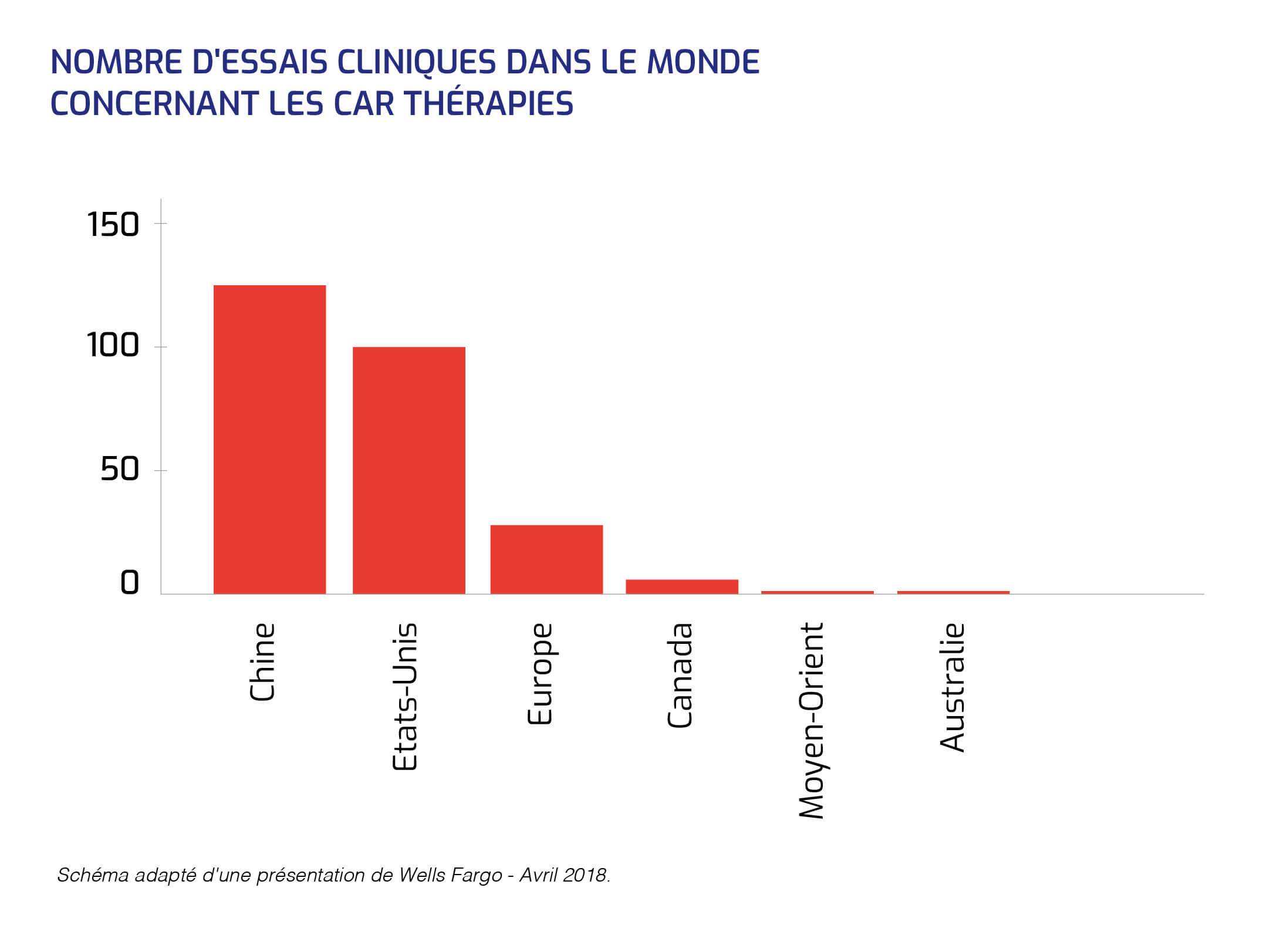
De nombreux essais sont en cours en oncologie. Car, la thérapie génique apparaît comme un formidable vecteur d'innovation en donnant au système immunitaire la capacité de détruire les cellules cancéreuses.
Une cinquantaine de patients dans le monde est aujourd’hui incluse dans des essais de thérapie génique qui consistent à "greffer" un gène sain de la bêta-globine chez des personnes atteintes de la drépanocytose.
Ce mécanisme était déjà utilisé dans les greffes de moelle réalisées pour traiter les leucémies : l'efficacité de la greffe repose sur l'action des lymphocytes du donneur présents dans le greffon, lesquels vont s'attaquer aux cellules leucémiques.
Le recours à un donneur compatible (souvent de la même famille) nécessite néanmoins de détruire au préalable le système immunitaire du patient greffé pour éviter le rejet.
D'où l'idée d'utiliser les lymphocytes du patient comme médicament afin d'éviter au maximum les phénomènes de rejet.
Les lymphocytes T-CAR sont les produits "industriels" développés à partir de cette idée : ils sont fabriqués à partir de lymphocytes T du patient puis modifiés génétiquement de manière à faire exprimer à leur surface un récepteur artificiel, dit chimérique (Chimeric Antigen Receptor - CAR), capable de reconnaître spécifiquement les cellules cancéreuses.
Ces lymphocytes T synthétiques peuvent ainsi reconnaître non seulement les complexes des HLA1, des peptides, mais aussi des structures telles que les sucres, les carbohydrates ou les glycolipides, qui peuvent être des cibles intéressantes sur les cellules cancéreuses.
En effet, les CAR ont des récepteurs alternatifs fonctionnant indépendamment du système de détection et de reconnaissance des cellules étrangères à l'organisme.
L'engouement pour la CAR thérapie vient du potentiel de cette technique : faire un médicament absolument spécifique, capable de distinguer les cellules tumorales des normales et réconciliant les impératifs parfois contradictoires de l'efficacité et de l'absence de toxicité.
Les défis à relever
• Le défi de la quantité de vecteurs
Plusieurs types de vecteurs peuvent être utilisés mais, à ce jour, les lentivirus semblent être les plus performants.
• Le défi de la qualité
La CAR thérapie est le résultat d'un assemblage de procédés et de techniques pour fabriquer des lymphocytes "designés" pour l'antigène cible.
Une des voies pour améliorer encore l'efficacité de la thérapie génique est d'utiliser la technique CRISPR-Cas9 afin d'éviter d'introduire le gène dans le lymphocyte T de manière aléatoire.
Ce qu'il faut dépasser
Ces nouveaux médicaments issus du vivant impliquent la maîtrise de technologies de transfert de gènes pour prélever des lymphocytes, les modifier, les réinjecter, et permettre à terme de soigner de nombreuses formes de cancers.
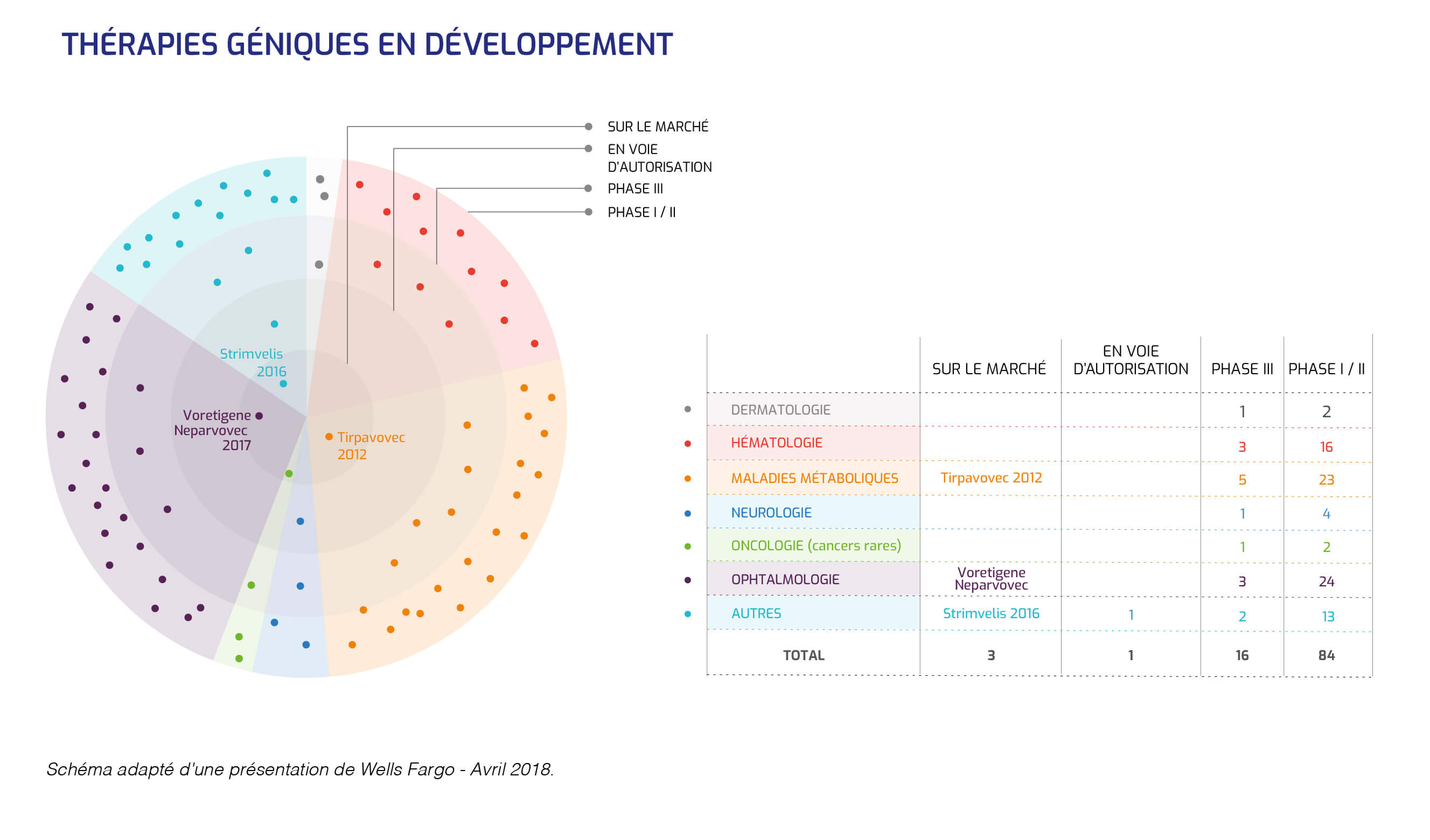
Il y a désormais plusieurs indications dans lesquelles la thérapie génique fonctionne : l'immunodéficience SCID-X1 des bébés bulles, l'adrénoleucodystrophie (maladie neurodégénérative), la bêta-thalassémie (maladie génétique de l'hémoglobine).
C'est le fruit d'une mobilisation pour cette recherche soutenue aussi par la Commission européenne avec des investissements de centaines de millions d'euros (programme Health, Horizon 2020).
La thérapie génique a pu ainsi atteindre un degré de maturité qui autorise son industrialisation.
La thérapie génique doit encore surmonter des obstacles réglementaires et industriels pour parvenir à fournir de nouveaux médicaments innovants.
La standardisation des médicaments viraux de thérapie génique reste un vrai défi, car il y a peu de médicaments de thérapies innovantes enregistrés, donc peu d'exemples à suivre pour éclairer le parcours du développement pharmaceutique de ce type de médicaments.
► La priorité est aujourd'hui de rendre les lymphocytes T-CAR accessibles aux patients atteints de lymphomes et de leucémies, mais aussi, plus largement, à ceux souffrant de cancers solides. Les tumeurs solides sont particulièrement douées pour se dissimuler et inhiber le système immunitaire.
Des travaux sont en cours pour mettre au point un lymphocyte T-CAR capable de reconnaître deux cibles au lieu d'une.
Fiche réalisée avec l'appui de Marc Peschanski, directeur scientifique d'I-Stem
Extrait de Santé 2030 - Partie 2 : les vecteurs d'innovation.
Retrouvez l'intégralité de l'étude sur le site.

