Le médicament et son économie
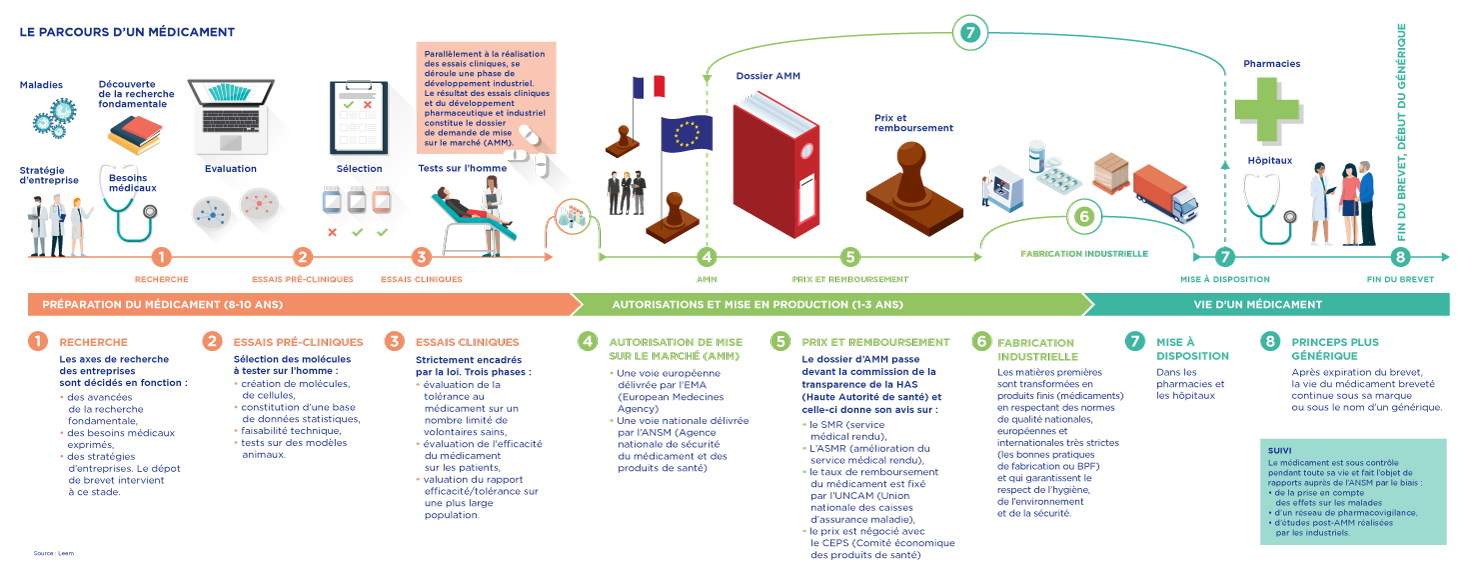
Parcours du médicament
Ce processus est long, coûteux et complexe.
Il n’est pas rare qu’il s’écoule près de dix ans entre la découverte en recherche fondamentale d’une nouvelle molécule et la décision d’AMM.
● La décision d’AMM est prise par la Commission Européenne sur proposition de l’EMA (European Medecines Agency), l’agence européenne de santé.
● Pour chaque demande d’AMM, l’EMA désigne deux pays rapporteurs, chaque rapporteur travaille en liaison avec son agence nationale. Pour la France, il s'agit de l’Agence nationale de sécurité du médicament (ANSM).
● Le dossier (très détaillé, en 5 parties), centré sur l’évaluation du rapport entre les bénéfices et les risques, est examiné par le Comité européen des médicaments à usage humain (Committee for Medicinal Products for Human Use, communément abrégé CHMP).
● L’ANSM est amenée à préciser ensuite les conditions particulières d’utilisation du nouveau médicament applicables en France. Les AMM sont délivrées pour une durée de cinq ans.