Etude thérapie cellulaire - Edition 2010
Les thérapies cellulaires préviennent ou traitent les pathologies humaines par l’administration de cellules vivantes.
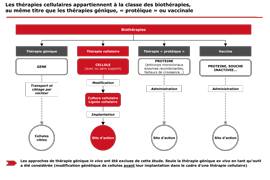
Définition de la thérapie cellulaire
Les thérapies cellulaires préviennent ou traitent les pathologies humaines par l’administration de cellules vivantes
La thérapie cellulaire a deux principales finalités :
- La médecine régénératrice dont le but est de remplacer des cellules déficientes ou de reconstituer des organes endommagés
- Les applications en oncologie (ces dernières ne sont pas traitées dans ce rapport)
Les cellules utilisées en médecine régénératrice sont principalement segmentées selon leur origine…
- Autologues, c’est-à-dire provenant du patient lui-même
- Allogéniques, c’est-à-dire provenant d’un don
…et leur niveau de différenciation (cellules souches ou cellules différenciées).
Etat des lieux
Une révolution scientifique s’est produite en 2006 : la découverte des iPS. Ces cellules souches ont les mêmes capacités que les cellules souches embryonnaires, mais sont produites à partir de cellules adultes.
Un essai clinique d’une thérapie utilisant des cellules souches embryonnaires a été autorisé aux Etats-Unis début 2009.
Les équipes françaises de recherche académique en thérapie cellulaire ont atteint une certaine masse critique pour compter au niveau international mais une dispersion géographique des équipes persiste.
La France possède le terreau nécessaire - encore insuffisamment exploité - à la création d’entreprises de thérapie cellulaire grâce à une recherche académique de haut niveau et des réseaux/bioclusters structurés.
En France, les produits de thérapie cellulaire sont considérés comme étant des médicaments ou des préparations de thérapie cellulaire.
Les autorités compétentes en France sont l'ANSM et l’Agence de la Biomédecine.
Au niveau européen, le Règlement « Médicament de Thérapie Innovante » est entré en vigueur en 2008 avec l’objectif d’harmoniser les législations des différents pays d’ici fin 2012.
Les produits de thérapie cellulaire qui ne répondent pas aux critères du Règlement « Médicaments de Thérapie Innovante » sont gérés selon la Directive « Tissus-Cellules ».
L'édition 2010 de l'étude thérapie cellulaire
La première étude avait été publiée en 2007, avec l'appui de Bionest Partners.
En 2009, suite aux échos et à l’impact très positifs recueillis par cette étude et dans la perspective de la révision de la loi de bioéthique, le Comité Biotechnologies du Leem avait décidé de :
- Mettre à jour l'édition 2007
- Elargir le champ de l’étude aux produits et matériels utilisés avec la thérapie cellulaire
- Approfondir l’intérêt des industriels de santé pour les outils dérivés des recherches en thérapie cellulaire, utilisables dans les phases de découverte de nouveaux médicaments (i.e. applications hors thérapeutique).

