Le médicament et sa mise au point
Pourquoi est-il difficile de mettre au point des médicaments pour les enfants ?
Les essais cliniques menés chez les adultes sont difficilement extrapolables.
Par ailleurs, mener des essais chez les enfants se révèle plus complexe.
En dépit de ces contraintes, les industriels, stimulés par le règlement européen sur les médicaments pédiatriques, ont accéléré le développement de médicaments adaptés aux enfants.
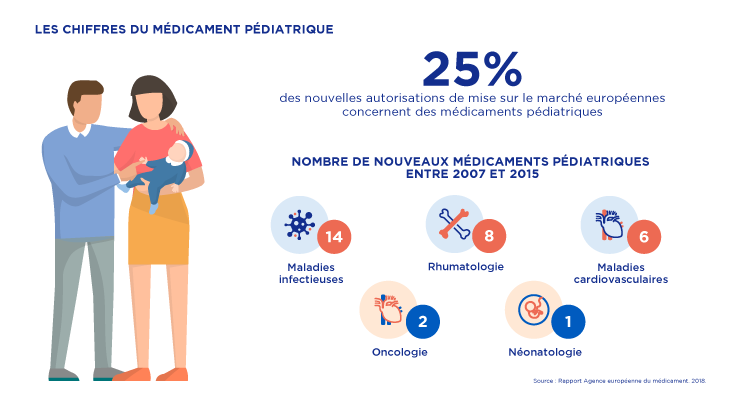
des nouvelles autorisations de mise sur le marché européennes concernent des médicaments pédiatriques. (1)
● Dans le cas de pathologies graves, les services hospitaliers prenant en charge des enfants ne disposent pas toujours des médicaments qui leur sont spécifiquement destinés.
Ils doivent alors utiliser ceux fabriqués pour les adultes, en adaptant empiriquement les doses selon l’âge, le poids et l’état général du patient.
● Par ailleurs, comme le rappelle l’Organisation mondiale de la santé (OMS), de nombreux médicaments destinés au traitement des maladies prioritaires, comme les antibiotiques, les antirétroviraux ou les antipaludéens, ne sont pas destinés aux enfants.
● Le règlement européen (CE) n° 1901/2006 a instauré un système, associant obligations et incitations, pour stimuler le développement de médicaments pédiatriques.
● Les industriels développant un nouveau médicament destiné à l’adulte mais pouvant être utilisé chez l’enfant doivent faire valider par l’Agence européenne du médicament (EMA) leur stratégie, présentée sous la forme d’un plan d’investigation clinique (PIP).
Ce dernier contient, entre autres, les mesures prévues pour évaluer la qualité, la sécurité et l’efficacité du médicament auprès de la population pédiatrique concernée.
● Le développement de médicaments en pédiatrie reste difficile et nombreux sont les obstacles auxquels se heurte la recherche clinique chez des enfants.
Au premier rang desquels figure le problème de recrutement, surtout lorsqu’il s’agit de maladies graves qui, et c’est heureux, concernent un petit nombre d’enfants.
Pour ces derniers, la participation à un essai clinique reste étroitement encadrée et réglementée.
● Les mineurs peuvent être sollicités pour se prêter à des recherches mentionnées aux 1° et 2° de l’article L. 1121-1 seulement si des recherches d’une efficacité comparable ne peuvent être effectuées sur des personnes majeures et dans les conditions suivantes :
○ soit l’importance du bénéfice escompté pour ces personnes est de nature à justifier le risque prévisible encouru ;
○ soit ces recherches se justifient au regard du bénéfice escompté pour d’autres mineurs.
Dans ce cas, les risques prévisibles et les contraintes que comporte la recherche doivent présenter un caractère minimal.
● L’un des défis demeure le recrutement de cohortes d’enfants en s’appuyant sur le réseau européen de recherche pédiatrique (Enpr-EMA), qui regroupe plus de 40 centres et réseaux ayant une expertise pédiatrique reconnue, l’objectif étant de favoriser les collaborations et les études de haute qualité.
● Stimulées par le règlement européen, les entreprises du médicament ont mis à disposition 200 médicaments pédiatriques entre 2007 et 2017.
● Elles ont amélioré l’information à disposition des médecins et des familles pour les médicaments déjà disponibles et les recherches en cours dans le domaine de l’oncologie pédiatrique. (1)
● En dépit de la difficulté à mener à bien des essais, elles continuent leurs recherches sur des sous-populations comme celle des nouveau-nés, qui ne représentent que 0,2 % des études pédiatriques.
Cette complexité n’a cependant pas empêché les industriels de mener à bien davantage d’essais cliniques pour les enfants : 32 études pédiatriques ont été lancées en France par les industriels en 2012, contre 15 en 2010.