Le médicament et son écosystème d'innovation
Médecine régénératrice : quelles avancées à ce jour ?
Pourtant, le nombre de traitements effectivement commercialisés, et surtout remboursés, reste limité aujourd’hui. En cause notamment, un modèle économique à revoir avec des coûts de production très élevés et des prix peu soutenables pour une collectivité.
(Maj : 23.03.2023)
À la fin du mois de juin 2022, 2 093 essais étaient en cours dans le monde. (1)
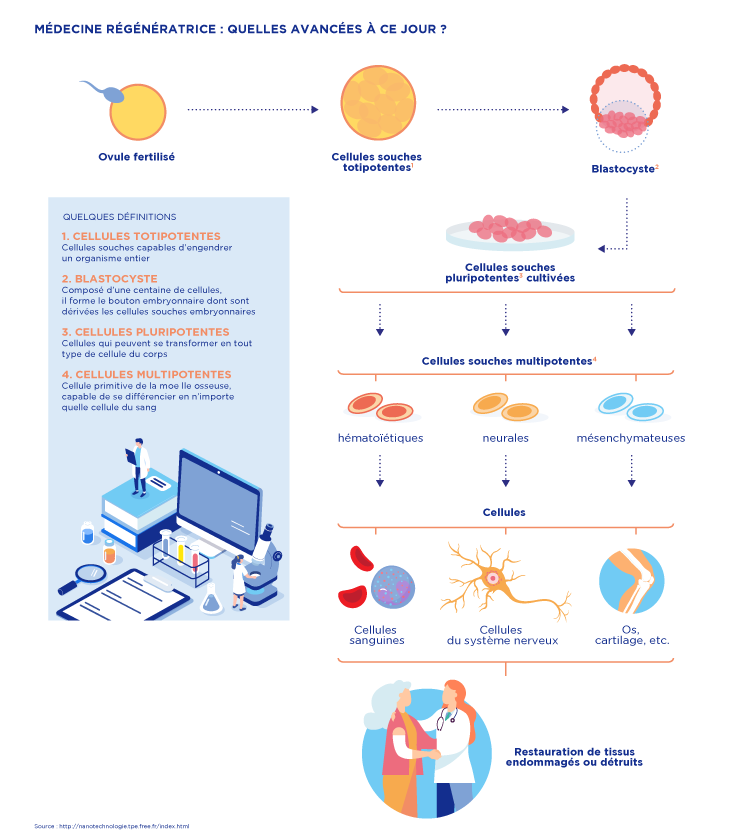
● La médecine régénératrice consiste à réparer une lésion ou un organe malade en remplaçant les parties endommagées par un nouveau tissu cellulaire créé à cet effet.
Elle repose sur la thérapie cellulaire, qui consiste à cultiver des cellules avant de les transplanter, et sur l’utilisation de cellules souches, c’est-à-dire non différenciées. Ces cellules sont dites pluripotentes car elles peuvent ensuite être transformées en différents types cellulaires.
● Les progrès de l’impression 3D offrent des perspectives prometteuses.
Elles permettent déjà, depuis quelques années, de fabriquer des couronnes dentaires ou des prothèses auditives sur mesure.
D’autres prothèses pourraient aussi être réalisées pour des personnes amputées d’une main par exemple.
● Demain, la bio-impression 3D – ou impression de tissus et d’organes – pourrait se généraliser.
En 2013, un patient britannique, dont une partie du visage avait été endommagée après l’ablation d’une tumeur, a bénéficié d’une greffe à partir d’une propre reproduction de son visage et de sa mâchoire, qui a été imprimée en trois dimensions.(2)
● L’une des applications majeures des cellules souches pluripotentes induites (IPS) est la médecine régénératrice.
Quelques applications cliniques de la recherche sur les cellules souches sont approuvées. Un très grand nombre de travaux de recherche sont en cours au niveau mondial. Plus de 26 000 patients sont traités avec des cellules souches sanguines chaque année en Europe. (3)
La transplantation de cellules souches sanguines pour traiter les maladies du sang et du système immunitaire ou reconstituer le système sanguin après traitements contre certains cancers est la plus utilisée des thérapies à base de cellules souches. Les cellules souches de la peau sont également utilisées depuis les années 80 pour faire pousser des greffons destinés au traitement des brûlures graves et très étendues.
Mais ces applications sont limitées par la quantité et la nature des cellules souches disponibles. Les cellules souches neurales adultes sont par exemple rares et très difficiles d’accès. Il n’est donc pas envisageable de traiter des maladies neurodégénératives par ce biais.
Les cellules IPS permettront de contourner cette difficulté et apporteront des solutions aux problèmes ne pouvant pas être résolus par l’utilisation des cellules souches adultes. (4)
● Des lignées de cellules IPS sont déjà disponibles pour étudier des dizaines de maladies comme la sclérose latérale amyotrophique, la maladie de Parkinson, le diabète de type 1, la maladie de Huntington, la trisomie 21, l’immunodéficience sévère combinée, le syndrome de Lesch-Nyhan, la maladie de Gaucher, le syndrome de Shwachman-Bodian-Diamond ou encore les dystrophies musculaires de Duchenne et de Becker.
● Dans le domaine de la neurobiologie, les chercheurs travaillent aujourd’hui à mieux comprendre les codes neuronaux, soit les signaux envoyés entre les neurones.
Cet objectif a motivé le lancement d’un vaste projet de recherche européen, Human Brain. (5)
Ces recherches pourraient permettre de mieux comprendre les maladies neurodégénératives et trouver de nouveaux traitements.
● La filière des industries de santé et les patients vivent depuis une vingtaine d’années une véritable révolution avec l'arrivée de médicaments dont les principes actifs sont produits à partir du vivant. L’essor de ces biomédicaments a permis d’ouvrir de nouveaux espoirs de traitements dans de multiples aires thérapeutiques (oncologie, immunologie, virologie, maladies rares…). Les biothérapies peuvent donc impacter le quotidien et la santé de millions de patients.
● Si elle dispose de nombreux atouts dans ce domaine, la France importe aujourd’hui 95% des biomédicaments vendus sur son territoire .
● Par ailleurs, si la diversité et la richesse de l’écosystème français en la matière est une véritable force, elle implique d’embarquer une multitude d’acteurs de sphères diverses pour les faire converger autour de projets et de réussites communes.
● Le 7 décembre 2022, l’association pour la production de biomédicaments en France, « France BioLead », a été officiellement lancée.
Créée par 15 membres fondateurs, acteurs de l’ensemble des chaînes de valeur de la bioproduction, son ambition est de structurer et piloter une filière unique de bioproduction française avec le soutien de l’État, pour faire de la France un leader de la bioproduction en Europe et restaurer l’indépendance et la souveraineté de la France dans ce domaine.