Le médicament et sa mise au point
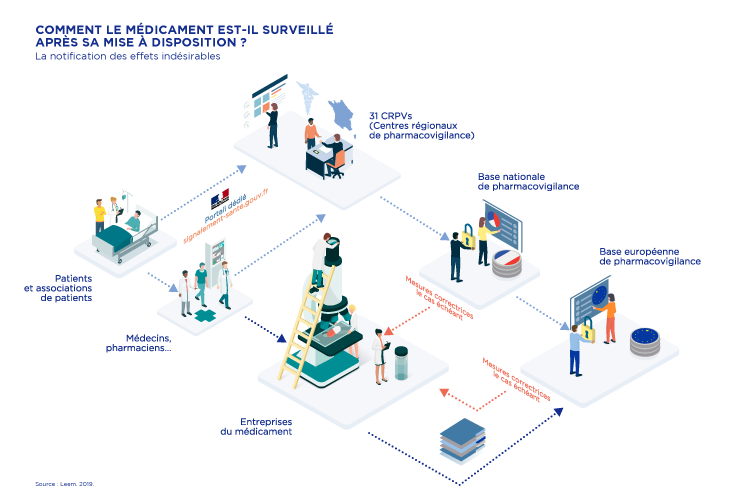
Comment le médicament est-il surveillé après sa mise à disposition ?
Elle a pour objectif premier de garantir la sécurité des patients.
Ce système permet en effet de repérer et prévenir les risques potentiels ou avérés d’effets indésirables.
Les entreprises du médicament participent activement à cette surveillance.
(Maj 31.05.2022)
cas d’effets indésirables ont été recueillis et enregistrés en 2020 dont 6 492 effets déclarés par des patients (source : ANSM, rapport 2020).
centres de pharmacovigilance récoltent ces déclarations.
● Avant que les médicaments ne soient commercialisés, des études cliniques approfondies évaluent leur efficacité mais aussi leurs effets indésirables.
Aussi rigoureuses soient-elles, ces études s’adressent à un nombre restreint de personnes et sont réalisées dans des conditions optimales de surveillance (suivi en continu, administration sur un temps limité, attention particulière portée aux personnes à risque et aux associations médicamenteuses), mais qui ne peuvent couvrir à elles seules tout le spectre de la vie réelle.
● Après sa commercialisation, le médicament est en effet prescrit plus largement et à des populations beaucoup plus variées, et des effets indésirables non connus et inattendus peuvent apparaître.
La pharmacovigilance permet de les identifier, de les quantifier, de les prévenir et de mieux connaître le profil de sécurité d’emploi du médicament et son évolution après sa commercialisation.
● La pharmacovigilance s’organise autour d’un système national dans le cadre d’une politique européenne. Tous les effets indésirables, graves ou non, attendus ou inattendus, sont à notifier.
● Les professionnels de santé ont une obligation de pharmacovigilance.
Mais depuis 2017, les patients et les associations de patients peuvent également déclarer un effet indésirable sur un portail de signalement des événements sanitaires indésirables : https://signalement.social-sante.gouv.fr/psig_ihm_utilisateurs/index.html#/accueil.
Ces déclarations sont récoltées par les 31 centres de pharmacovigilance.
● La réception d’un ou de plusieurs cas de pharmacovigilance en France peut constituer un signal de sécurité après évaluation par l’Agence nationale de sécurité du médicament et des produits de santé (ANSM).
Cette dernière peut alors prendre les mesures qui s’imposent afin de prévenir les risques ou de les réduire en vue d’assurer la sécurité d’emploi des médicaments.
● Le système français de pharmacovigilance repose sur la notification spontanée, dont le caractère « ouvert », non directif, favorise la mise en évidence d’effets indésirables nouveaux.
Cependant, un phénomène de sous-notification existe.
Augmenter la notification nécessite toutefois de disposer de moyens de traiter l’information, notamment parce que repérer un signal faible de pharmacovigilance devient très difficile dès lors que le « bruit de fond » généré par le volume des notifications augmente.
● Par ailleurs, la pharmacovigilance permet de faire émerger des signaux d’alerte, mais elle ne donne pas le nombre de personnes concernées.
Obtenir cet élément nécessite des enquêtes plus approfondies et plus coûteuses.
L’un des enjeux est de capitaliser sur l’analyse des données de santé et le développement de l’intelligence artificielle pour parvenir à mener « en routine » ces études.
● Les entreprises du médicament cherchent en permanence à mieux connaître les effets indésirables des médicaments qu’elles conçoivent pour mieux les prévenir et les limiter.
Elles exercent un contrôle renforcé sur les médicaments grâce à un cadre réglementaire strict en matière de pharmacovigilance, avec des obligations de surveillance et de signalement des effets indésirables, mais également par la mise en place de mesures d’information des professionnels de santé et des patients.
● Elles mettent notamment en place des plans de gestion des risques, c’est-à-dire un ensemble de mesures de surveillance spécifique, dès la commercialisation d’une nouvelle substance active pour chercher les signaux qui pourraient conforter des suspicions.
Ces mesures sont issues de la crise sanitaire d' un anti-inflammatoire retiré du marché en 2004 en raison d’effets secondaires importants.
Dès le début de sa commercialisation, des suspicions d’effets cardiovasculaires sont apparues, reposant sur certaines bases théoriques et pharmacologiques, mais sans preuves cliniques à même de les étayer.
Cette crise a soulevé la question de la prévention d’accidents que l’on suspecte mais qui n’ont pas été mis en évidence lors des essais cliniques.
● Au stade de la recherche, lors du développement du médicament, les entreprises agissent pour accroître la connaissance de la toxicité des médicaments, grâce à l’utilisation de l’imagerie et des tests biologiques.
Les « biomarqueurs de sécurité » sont notamment capables d’identifier la sous-population de patients pour laquelle les effets indésirables seront les moins marqués.