Délais d’accès aux médicaments innovants : pourquoi les chiffres du Leem et ceux de l’Assurance maladie sont différents ?
- Le rapport Charges et Produits de la CNAM, à paraître le 6 juillet 2023, présente également une étude des délais d’accès, menée sur des bases différentes. Il laisse à penser que les chiffres des entreprises du médicament (étude W.A.I.T de l’EFPIA et Observatoire de l’accès et de l’attractivité du Leem) divergent et ne prendraient pas en compte les mécanismes d’accès précoce.
- Une communication presse du ministère de la Santé est prévue le 6 juillet 2023 sur le thème des délais d’accès.
1. Les chiffres du Leem sont aussi corrects que ceux de la CNAM, mais répondent à des questions différentes
- L’étude de la CNAM répond à la question : « En combien de temps le premier patient a-t-il eu accès aux médicaments évalués comme innovants par la Haute autorité de santé (ASMR I-IV) et actuellement remboursés ? »
- L’Observatoire de l’accès du Leem répond à d’autres questions :
- « Quelle proportion des médicaments autorisés en Europe est accessible sur le marché français, en comparaison avec les autres pays européens ? »
- « Combien de temps après leur autorisation les médicaments sont-ils accessibles pour l’ensemble des patients (donc hors accès dérogatoires qui ne concernent pas l’ensemble des patients) ? »
- « Combien de temps durent les étapes de l’accès à un médicament en France ? »
- Le périmètre retenu par l’Observatoire du Leem n’est pas manipulé, il donne une vision plus large que celui de la CNAM
- L’étude de la CNAM se limite aux médicaments évalués comme innovants par la HAS (ASMR I à IV), mais également déjà remboursés. Par exemple, les médicaments toujours en cours d’évaluation ou de négociation de prix ne sont pas retenus dans les calculs.
- L’Observatoire du Leem inclut l’ensemble des médicaments autorisés en Europe, indépendamment de leur niveau d’évaluation.
- Il est pertinent d’observer le devenir des médicaments évalués par la HAS « sans amélioration du service médical rendu » (ASMR V). En effet, les ASMR V relèvent de logiques variées : il peut s’agir d’alternatives thérapeutiques pour des patients non répondeurs aux traitements déjà disponibles, d’améliorations galéniques permettant par exemple de diminuer le nombre d’injections ou de prise, de médicaments innovants pour lesquels des données complémentaires sont attendues, de médicaments orphelins apportant une réelle innovation mais dont le développement ne pouvait matériellement pas répondre aux critères méthodologiques de la HAS… Réglementairement, un médicament d’ASMR V doit apporter des économies dans la prise en charge : leur arrivée rapide est souhaitable pour l’Assurance maladie.
- Il est pertinent d’observer le « stock » de médicaments non encore remboursés : ces situations peuvent être révélatrices de blocage dans les mécanismes d’accès des patients aux médicaments.
- Le Leem reconnaît sans ambiguïté le bénéfice des mécanismes d’accès précoce pour l’accès du premier patient aux médicaments innovants mais rappelle qu’il s’agit de mécanismes d’exception, qui ne peuvent pas se substituer à un accès « de droit commun » rapide
- 17% des nouveaux médicaments autorisés entre 2018 et 2021 sont disponibles en France grâce aux mécanismes d’accès précoce.
- Ils permettent de réduire de près d’un an le délai d’accès au premier patient par rapport aux médicaments n’en ayant pas bénéficié.
- Ils ne donnent cependant pas accès au médicament pour l’ensemble des patients qui en ont besoin :
- L’ensemble des médicaments (y compris innovants) n’est pas éligible à l’accès précoce qui répond à des critères stricts ;
- Les indications bénéficiant des accès précoces sont très souvent réduites par rapport aux indications qui bénéficieront in fine du remboursement de l’Assurance Maladie ;
- L’accès à un médicament en accès précoce peut être inégal sur le territoire national ;
- L’ANSM a récemment communiqué qu’environ 50 000 patients bénéficiaient d’un traitement en accès précoce en 2022, alors que plus d’une dizaine de millions de patients recevaient un traitement médicamenteux en France.
- Lorsque la CNAM et le Leem étudient un même indicateur (délais d’évaluation par la HAS), leurs chiffres sont similaires
- La CNAM relève un délai d’évaluation de 176 jours par la Commission de la Transparence (CT) de la HAS après dépôt de la demande de remboursement, sur l’échantillon de produits observé[1].
- L’Observatoire de l’accès du Leem relève un délai médian d’évaluation par la HAS compris entre 140 et 180 jours ces dernières années (comprenant les avis de la CT et de la CEESP).
- L’étude de la CNAM n’analyse pas les délais de négociation de prix et de publication des inscriptions au Journal Officiel, délais sur lesquels l’Observatoire du Leem constate une dégradation significative ces dernières années.
6. Au-delà des délais d’accès des patients aux médicaments, l’Observatoire du Leem analyse l’attractivité de la France et constate la dégradation des résultats macro-économiques du secteur, analyse confirmée par l’étude de Rexecode publiée le 4 juillet 2023[2].
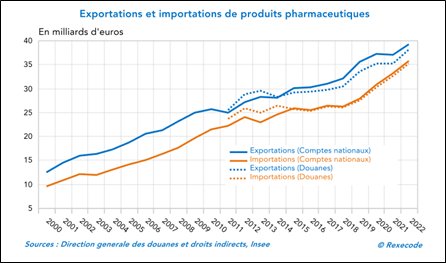
- L’industrie pharmaceutique génère un bénéfice commercial important et durable pour la France.
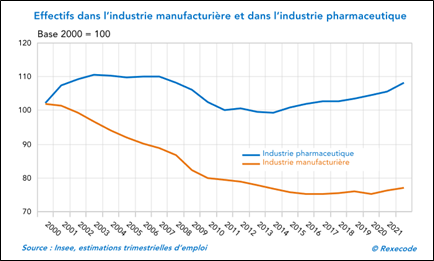
- L’industrie pharmaceutique a maintenu ses effectifs en France depuis les années 2000, là où les autres secteurs les ont réduits.
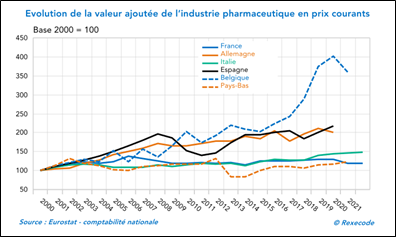
- Pour autant, la valeur ajoutée de l’industrie pharmaceutique française a connu la plus faible progression des principaux pays européens depuis les années 2000…
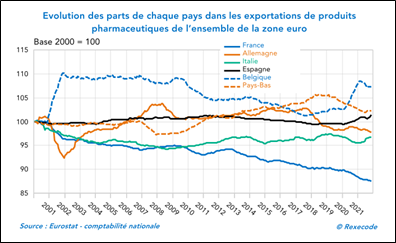
- … et la France enregistre une perte significative de part de marché de produits pharmaceutiques à l’export.
7. Au-delà des débats sur les chiffres des délais d’accès, cette dégradation des résultats de l’industrie pharmaceutique doit amener les pouvoirs publics à repenser la politique globale du médicament et son pilotage dans notre pays.
[1] Note : les délais d’avis de la Commission d’évaluation économique et de santé publique (CEESP) ne sont pas précisés dans l’étude de la CNAM, malgré le fait qu’ils sont nécessaires pour débuter la négociation de prix.
[2] Enjeux macroéconomiques de la régulation économique du médicament - Document de travail N.86 (juillet 2023), Rexecode, Olivier REDOULES & Gilles KOLEDA

